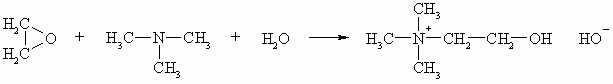Nomenklatur der Amine
Amine leiten sich vom Ammoniak durch Ersatz eines oder mehrerer Wasserstoffatome durch Alkylreste ab. Anders als bei den Alkoholen geben die Begriffe primäres, sekundäres und tertiäres Amin an, ob der Stickstoff ein, zwei oder drei Reste trägt. Die weitere Alkylierung eines tertiären Amins führt zu quartären Ammoniumsalzen.
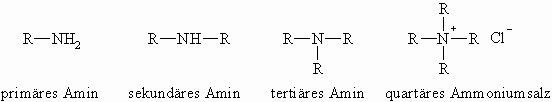
Die systematische Bezeichnung der primären Amine erfolgt durch Anhängen von –amin an den Namen des Kohlenwasserstoffrestes, der mit dem Stickstoffatom verbunden ist. Sind mehrere organische Reste vorhanden (sekundäre und tertiäre Amine), wird, wenn es sich um gleiche Substituenten handelt, das Zahlwort Di- oder Tri- vorgestellt, bei ungleichen Resten werden diese nacheinander alphabetisch genannt. Analog werden bei quartären Ammoniumsalzen die Reste vor –ammonium gestellt. Danach folgt der Name des Anions.
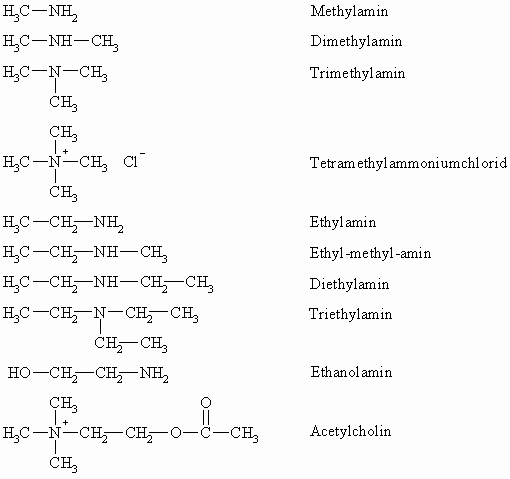
Im folgenden Schema werden noch einige komplizierter aufgebaute Amine mit cyclischen Strukturen vorgestellt. Sie tragen Trivialnamen, die zum Teil sicherlich bekannt sind.
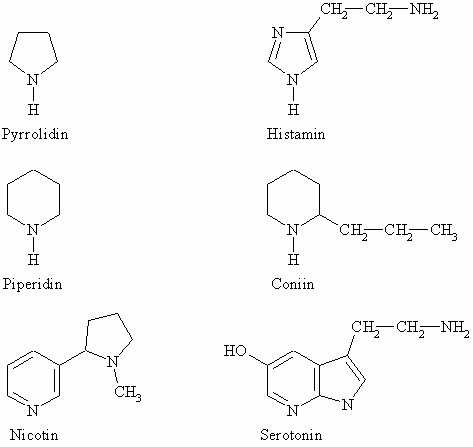
Pyrrolidin und Piperidin stellen die Grundstruktur eines Fünf- bzw. Sechsringamins dar. Diese finden sich z.B. in Nicotin (Inhaltsstoff der Tabakpflanze) und Coniin (Inhaltsstoff des gefleckten Schierlings) wieder. Beide Verbindungen zählen zu einer großen Klasse von Naturstoffen, den Alkaloiden. Histamin und Serotonin sind biogene Amine.
Eigenschaften von Aminen
Vergleicht man die Siedepunkte der Amine mit denen der Kohlenwasserstoffe mit ähnlichem Molekulargewicht, so sind sie in den Fällen, in denen das Stickstoffatom noch wenigstens ein Wasserstoffatom trägt (primäre und sekundäre Amine), deutlich erhöht. Diese Siedepunktserhöhung ist wie bei den Alkoholen auf die Ausbildung von Wasserstoffbrücken zurückzuführen. Da die Differenzen der Siedepunkte der Amine zu denen der Kohlenwasserstoffe nicht so groß wie die der Alkohole zu denen der Alkane sind, kann man folgern, dass die N–H–N-Brückenbindungen schwächer als die O–H–O-Brücken sind. Tertiäre Amine, bei denen wie bei den Ethern zwischen den Molekülen keine Wasserstoffbrücken mehr möglich sind, sieden daher auch in einem ähnlichen Bereich wie die Alkane mit vergleichbarem Molekulargewicht.
Auf die Fähigkeit zur Bildung von Wasserstoff-Brückenbindungen ist auch zurückzuführen, dass die Amine in Wasser oder Alkoholen löslich sind, wobei wie bei den Alkoholen die Wasserlöslichkeit mit zunehmender Größe des Alkylrestes abnimmt.
Darstellung von Aminen
Während Alkohole durch die Umsetzung von Alkalihydroxiden mit Alkylhalogeniden leicht zugänglich sind und die Reaktion auch auf dieser Stufe stehenbleibt, ohne dass es darüber hinaus zur Bildung von Ethern kommt, ist die Synthese rein primärer Amine bei Verwendung von Ammoniak nicht möglich. Es entsteht vielmehr ein Gemisch von Salzen des primären, sekundären und tertiären Amins. Darüber hinaus enthält das Gemisch auch noch das quartäre Ammoniumsalz.
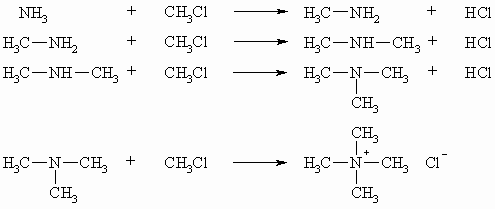
Es handelt sich hier um Substitutionsreaktionen wobei das Alkylhalogenid von Ammoniak bzw. den Aminen nucleophil angegriffen wird.
Reaktionen von Aminen
Amine haben, wie der Ammoniak, basische Eigenschaften. Durch das freie, nicht bindende Elektronenpaar am Stickstoff sind sie in der Lage, ein Proton aufzunehmen. So setzen sie aus Wasser HO– frei und sie bilden mit anorganischen und organischen Säuren Salze.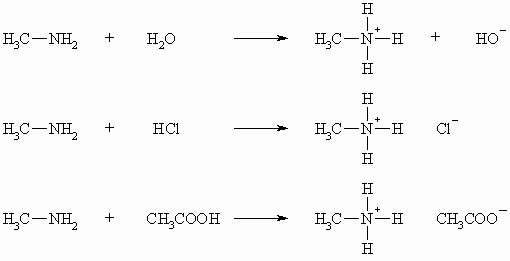
In der Basizität einzelner Amine gibt es große Unterschiede wie man den nachfolgenden KB-Werten entnehmen kann. Die schwache Basizität der aromatischen Amine (C6H5-NH2 und (C6H5)2NH) liegt daran, dass hier das freie Elektronenpaar des Stickstoffs durch Mesomerie mit den Resten delokalisiert ist.
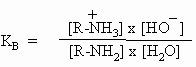
| NH3: | KB = 1,8 x 10-5 | C6H5-NH2: | KB = 3,8 x 10-10 |
| CH3-NH2: | KB = 4,4 x 10-5 | (C6H5)2NH: | KB = 7,6 x 10-14 |
Primäre Amine reagieren mit salpetriger Säure unter Bildung von molekularen Stickstoff. Diese Reaktion kann man zum Nachweis von primären Aminen nutzen.
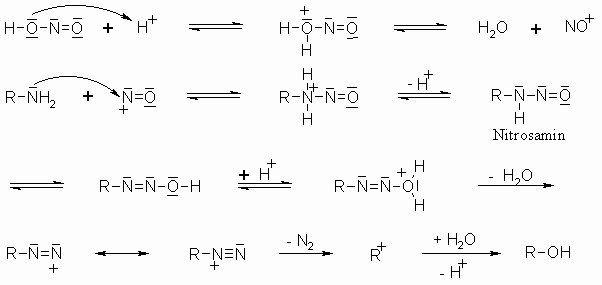
Sekundäre Amine reagieren nach dem gleichen Mechanismus, aber nur bis zur Stufe des Nitrosamins. Da in dieser Verbindung der Stickstoff kein Proton mehr trägt, ist auch die weitere Reaktionsfolge, bei der ja ein Proton vom Stickstoff zum Sauerstoff wandert, nicht mehr möglich. Die Nitrosamine sind stark gesundheitsschädlich. Sie haben eine cancerogene Wirkung.
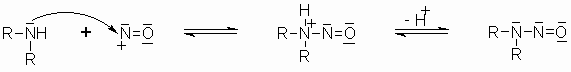
Tertiäre Amine reagieren nicht mit salpetriger Säure, da hier keine Abspaltung eines Protons zum Nitrosamin erfolgen kann.
Aus Ethylenoxid und Trimethylamin lässt sich Cholin darstellen. Cholin ist ein Baustein des Lecithins. Sein Acetylderivat wirkt blutdrucksenkend und muskelkontrahierend.