Vitalitätstest und Keimfähigkeitstest mit TTC-Methode
Ziele
Der Erhalt der Vitalität von Zellen ist eine Forderung der meisten Manipulationen in der Biotechnik.Sterilisation von Gewebeoberflächen kann Teil biotechnischer Maßnahmen im Zuge von Arbeiten:
- In der Primärkultur von Leberzellen (Hepatozyten) zur in vitro-Testung von Medikamenten,
- Bei der Gewinnung haploider Zellen (Zellen mit einfachem Chromosomensatz, z. B. Sporen und Pollen) aus den Staubgefäßen von Blütenpflanzen
- Der Kontrolle bei der Archivierung vitaler Samen,
- Vermehrung von Pflanzen aus Pflanzenteilen u. v. m.
sein. Im Versuch werden Getreidekörner mittels unterschiedlicher Desinfektionsverfahren keimfrei gemacht und die Auswirkung dieser Behandlung auf die Viabilität der Körner / Gewebe vergleichend statistisch untersucht (χ²-Verfahren).
Theoretischer Hintergrund
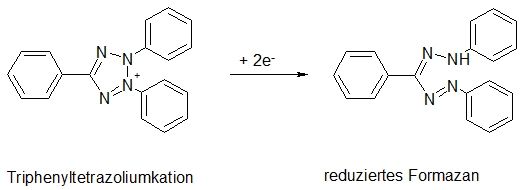
Während einerseits Bakterien und Pilze auf der Oberfläche der Gewebe oder Organe durch Oberflächensterilisation zu töten sind, sollen die zu gewinnenden Zellen andererseits vital bleiben. Eukaryotische Zellen besitzen neben ihrem Zellkern die für den Hauptanteil der Energiegewinnung durch Zellatmung maßgeblichen Mitochondrien. Um ATP („Energiewährung“ der Zelle) produzieren zu können, stellen Mitochondrien in ihrem Stoffwechsel die Reduktionsäquivalente NADH und H+ her. In die Zelle eingeführte Wasserstoffakzeptoren gehen durch NADH + H+ in ihre reduzierte Form über. In vitalen Mitochondrien befindlichen Reduktase überführen die Chromogene TTC und MTT (Triphenyltetrazoliumchlorid und Dimethylthiazoldiphenyltetrazoliumbromid) von ihrer farblosen oxidierten Zustand in die farbige reduzierte Form. Das im Fall des TTC entstandene Formazan ist unlöslich und bleibt in der Zelle, die dadurch eine rote Farbe annimmt. Aktuell wird auch die Beteiligung von Reduktasen des endoplasmatischen Retikulums an der Farbreaktion diskutiert. Da die beteiligten Reduktasen in toten Zellen sehr schnell inaktiviert werden, zeigt die entstehende Farbe die Vitalität der betreffenden Zelle an.
 Versuchsobjekte und Chemikalien
Versuchsobjekte und Chemikalien
- Weizen- oder Gerstenkörner
- 0,5%-ige wässrige TTC-Lösung
- Desinfektionslösung je nach Aufgabenstellung 80%-Ethanol, 60%-2-Propanol, 3%ige-Formalinlösung, 10%-Chlorbleiche (Toilettenreiniger) o. ä.
Geräte
- Stereolupe
- Teesieb
- kleine Bechergläser
- Petrieschalen
- Scharfes Skalpell
- Papierküchentuch
- Vakuumpumpenstand mit Exsikkator
Durchführung
Je 2 Personen betreuen einen Versuchsansatz. Schlussfolgerungen über Auswirkungen der Behandlung auf die Viabilität der Körner lassen sich nur im Vergleich zu den Ergebnissen einer Stichprobe mit unbehandelten Körnern treffen. Demnach sind mindestens 2 Versuchsansätze erforderlich. Die Keimfähigkeit von Saatgut sollte <95% betragen.
Für jeden Versuchsansatz wird eine Stichprobe von 100 unbeschädigten Körner eines Getreidejahrgangs gezogen.
Abhängig von der geplanten Behandlungsart inkubieren die Körner für 10 Minuten in einer Desinfektionslösung (bzw. Wasser bei der Kontrollprobe).
Anschließend werden die Körner kurz mit Wasser abgespült und mit dem Skalpell sorgfältig längs halbiert. Zum Schneiden empfiehlt sich die Lagerung des jeweiligen Korns auf dem Küchenpapier.
Die in ein kleines Becherglas oder eine Petrischale überführten Kornhälften werden mit einer Menge TTC-Lösung so überschüttet, dass die Lösung alle Kornhälften bedeckt. Da das Formazan lichtempfindlich ist, werden die Gefäße mit einer perforierten Alufolie abgedeckt bevor sie für 30 Minuten im Exsikkator unter Membranpumpenvakuum inkubiert werden.
Vor ihrer Bewertung unter der Stereolupe sind die Kornhälften mit Wasser abzuspülen (Hautkontakt mit TTC ist zu vermeiden).
Die Bewertung erfolgt als Bonitur indem zunächst zu Vergleichszwecken eine keimfähige (roter Embryo) sowie eine nichtkeimfähige (blassrosa oder farbloser Embryo) Kornhälfte als Referenzkronhälften in dem Begutachtungsraum der Stereolupe platziert und die verbleibenden Kornhälften mit diesen verglichen und sortiert werden.
Nach dem vorsichtigen Durchmischen der Kornhälften werden die Kornhälften in gleicher Weise vom Versuchspartner bonitiert.
Aller Erfahrung nach entstehen in der Bonitur 3 Bewertungsgruppen, da es neben den bewertbaren Kornhälften auch nicht bewertbare Kornhälften gibt, die sich durch falsche Schnittführung oder dem Verlust des Embryos im Zuge der Handhabung ergeben.
Auswertung
Die Ergebnisse des eigenen Versuchsansatzes werden mit dem gemittelten Ergebnis der Kontrollgruppe(n) mittels χ²-Verfahren verglichen. Gibt es nur eine Kontrollgruppe vergleicht die Kontrollgruppe ihren Befund mit der Erwartung einer 95%-igen Keimfähigkeit.
Abgaben
- Übersichtsskizze einer Kornhälfte
- In Deckel und Boden einer Petrischale sortierte Kornhälften
- Berechnung und Aussage bezüglich des Signifikanzgrades eines möglichen Einflusses der gewählten Behandlung.
Praktikumsskript: Keimfähigkeitsuntersuchungen
