Nomenklatur der Alkene
Die Alkene bilden eine homologe Reihe mit der allgemeinen Summenformel CnH2n sofern das Molekül nur eine Doppelbindung besitzt und nicht cyclisch ist. Es handelt sind um Kohlenwasserstoffe mit C=C-Doppelbindungen. Man spricht auch von ungesättigten Kohlenwasserstoffen. Die beiden Kohlenstoffatome an der Doppelbindung sind sp2-hybridisiert, d.h. sie haben drei Hybridorbitale (aus dem 2s- und zwei 2p-Orbitalen), die in die ![]() Ecken eines gleichseitigen Dreiecks orientiert sind, und ein p-Orbital, das senkrecht zur Dreiecksebene steht. Durch Überlappung je eines der sp2-Hybridorbitale der beiden Kohlenstoffatome entsteht eine Bindung (s-Bindung) und durch Überlappung der p-Orbitale eine zweite (p-Bindung). In der C=C-Doppelbindung stehen die Ebene der p-Elektronen und die der s-Bindungen (= Dreieckebene) senkrecht aufeinander. Eine C=C-Doppelbindung ist deshalb starr und nicht drehbar. s- und p-Bindung der C=C-Doppelbindung sind in ihrer Natur verschieden und zeigen eine unterschiedliche Reaktivität.
Ecken eines gleichseitigen Dreiecks orientiert sind, und ein p-Orbital, das senkrecht zur Dreiecksebene steht. Durch Überlappung je eines der sp2-Hybridorbitale der beiden Kohlenstoffatome entsteht eine Bindung (s-Bindung) und durch Überlappung der p-Orbitale eine zweite (p-Bindung). In der C=C-Doppelbindung stehen die Ebene der p-Elektronen und die der s-Bindungen (= Dreieckebene) senkrecht aufeinander. Eine C=C-Doppelbindung ist deshalb starr und nicht drehbar. s- und p-Bindung der C=C-Doppelbindung sind in ihrer Natur verschieden und zeigen eine unterschiedliche Reaktivität.
Die für die Alkane gebräuchlichen Namen gelten auch für die Alkene, doch tritt bei diesen anstelle der Endsilbe –an das Suffix –en. Die Lage der Doppelbindung wird mit der Zahl des C-Atoms beschrieben, von der die Doppelbindung ausgeht. Dies ist natürlich erst ab dem Buten nötig da ab hier Isomere vorkommen.

Eigentlich sollte die Zahl wie oben vor das –en gestellt werden, es ist aber auch erlaubt, die Zahl vor oder hinter den Namen zu stellen, also z.B. 1-Penten bzw. Penten-1. Da die Doppelbindung, wie oben gezeigt, nicht drehbar ist, können bei den Alkenen auch cis– und trans-Isomere vorkommen, wie z.B. bei But-2-en. Die beiden Methylgruppen stehen dabei entweder auf der gleichen (cis) oder auf gegenüberliegenden (trans) Seiten. Die Terminologie der cis–trans Isomerie erwies sich jedoch beim Vorliegen mehrerer, verschiedener Reste an den beiden C-Atomen der Doppelbindung als nicht ausreichend. Es wurde deshalb eine andere, generellere Bezeichnung eingeführt: Stehen die beiden größeren Substituenten (höhere Atomnummer) auf er gleichen Seite nennt man dies die (Z)-Form (von zusammen), im anderen Falle ist es die (E)-Form (von entgegen).
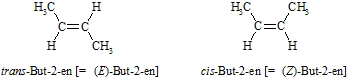
Darstellung von Alkenen
Alkene lassen sich durch Eliminierungsreaktionen aus substituierten Alkanen herstellen. So kann man z.B. aus einen Halogenalkan Halogenwasserstoffsäure oder aus einem Alkohol Wasser abspalten.
![]()
Obige Reaktionsgleichungen geben nur an, welche Ausgangssubstanzen (hier: Bromethan bzw. Ethanol) zu welchen Produkten (hier: Ethen) umgesetzt werden, aber nicht wie die Reaktion mechanistisch abläuft. Die Verwendung eines Alkohols erfordert eine Dehydratisierung, wobei die Hydroxylgruppe und von einem benachbarten Kohlenstoffatom ein Proton unter saurer Katalyse eliminiert werden. Der Einfluss der Säure ist erst im folgenden Reaktionsmechanismus erkennbar.
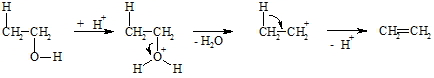
Die Hydroxylgruppe im Alkohol hat, wie das Wasser, basische Eigenschaften und kann deshalb ein Proton aufnehmen. H2O ist gegenüber HO– eine gute Austrittsgruppe. Zurück bleibt ein Carbokation, das sich durch Abgabe eines Protons vom Nachbarkohlenstoffatom stabilisiert. Die benutzten Pfeile in der Formeldarstellung geben Auskunft, in welcher Weise das Elektronensystem des Moleküls verändert wird. Diese Dehydratisierung wird meist durch Erhitzen mit Schwefelsäure durchgeführt, da diese Wasser entziehend wirkt und somit das Gleichgewicht nach rechts verschiebt.
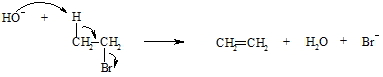
Die Abspaltung von Halogenwasserstoff (hier: HBr) verläuft nach dem gleichen Prinzip der ß-Eliminierung. Diese Reaktion wird mittels einer Base, die den Halogenwasserstoff bindet, durchgeführt.
1.3. Reaktionen von Alkenen
Der ungesättigte Charakter der Alkene zeigt sich vor allem in der Neigung, bestimmte Reagenzien zu addieren und so in den gesättigten Zustand überzugehen, d.h., die Doppelbindung wird aufgehoben. Addieren lassen sich u. a. Wasserstoff, Brom, Wasser und Halogenwasserstoff. Wird an ein Alken Wasserstoff addiert, so entsteht ein Alkan. Man benutzt hierzu Katalysatoren wie Nickel, Palladium oder Platin. Dabei findet eine Oberflächenreaktion statt, bei der das Alken sowie der Wasserstoff an der Metalloberfläche adsorbiert werden. Durch Umorientierung der Bindungen zwischen den fixierten Wasserstoff- und Alkenmolekülen entsteht dann das Alkan, das vom Katalysator desorbiert. Dieser Mechanismus erklärt, dass der Wasserstoff cis-ständig an die Doppelbindung angelagert wird. Bei der Addition von Wasserstoff an 1,2-Dimethyl-cyclohex-1-en entsteht nur cis-1,2-Dimethyl-cyclohexan und nicht das trans-Produkt.
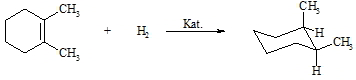
Einem anderen Mechanismus folgt die Addition von Halogenen, Halogenwasserstoffen und von Wasser. Hierbei handelt es sich um elektrophile Reaktionen. Die Umsetzung von Cyclohexen mit Brom liefert ausschließlich trans-1,2-Dibromcyclohexan.
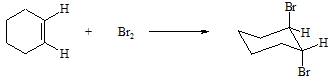
Auch dieser Befund muss über den Reaktionsmechanismus erklärt werden. Es bildet sich zunächst eine lockere Bindung zwischen dem Alken und dem Brommolekül aus, die durch die p-Elektronen der Doppelbindung vermittelt wird. In diesem p-Komplex (1) wird gleichzeitig auch die Bindung zwischen den beiden Bromatomen polarisiert bis die Ablösung eines Bromid-Ions erfolgt. Es entsteht dabei ein cyclisches Bromonium-Ion (2), das vom Bromid-Ion nur in trans-Stellung angegriffen werden kann. Die Addition von Brom verläuft äußerst schnell und dient als Nachweisreaktion für Alkene.
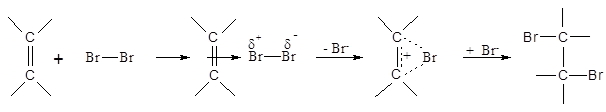
p-Komplex (1) 2
Besteht gleichzeitig eine genügend hohe Konzentration an Fremdanionen (z.B. Cl–), so können diese naturgemäß in Konkurrenz zum Bromidion treten, so dass die Bildung eines gemischten Dihalogenids verständlich ist. Solche Befunde untermauern die Richtigkeit eines angenommenen Reaktionsverlaufes. Auch die Additionen von Halogenwasserstoff und von Wasser im sauren Medium folgen einem elektrophilen Mechanismus. Zuerst greift ein Proton die p-Elektronen der Doppelbindung unter Ausbildung eines Carbokations an. Danach lagert sich daran das Halogenid bzw. das Wasser an. In letzterem Falle wird nun noch ein Proton am Sauerstoff unter Bildung einer Hydroxylgruppe abgespalten, d.h., für das zu Beginn der Reaktion benötigte Proton wird nachher wieder eines frei. Somit werden nur katalytische Mengen Säure benötigt.
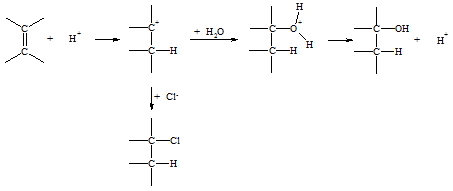
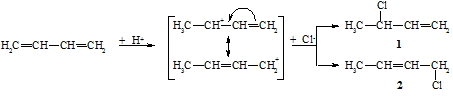
Bei Addition eines unsymmetrischen Agenses H-X (z.B. H-OH, H-Cl) an ein unsymmetrisches Alken (z.B. Propen) können theoretisch die zwei isomere Produkte 1 und 2 entstehen:
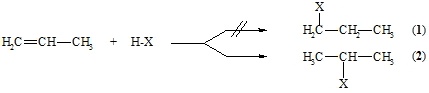
Tatsächlich jedoch wird nach einer dem ionischen Mechanismus folgenden Reaktion immer nur das Produkt gefunden bei dem das Proton an das Kohlenstoffatom tritt, das die meisten Wasserstoffatome enthält (bei obigem Beispiel Produkt 2). Dies ist die schon 1870 aufgestellte Regel von Markownikoff. Die Reaktion wird, wie oben gezeigt, mit der Protonierung des Alkens eingeleitet, wobei das thermodynamisch stabilste Carbokation gebildet wird. Da die Alkylgruppen stärker elektronendrückend als Wasserstoffatome sind, nimmt die Stabilität der Carbokationen in der Reihenfolge primär, sekundär, tertiär zu.
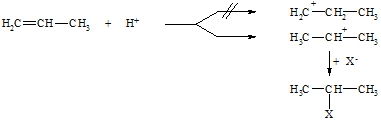
Nach Karash lassen sich Verbindungen vom Typ H-X in Gegenwart von Radikalbildnern (z.B. Peroxide, R-O-O-R) gleichfalls an Alkene addieren, jedoch in einem der Markownikoff-Regel entgegengesetzten Sinne. Die Reaktion verläuft dabei nach einem Radikal-Ketten-Mechanismus. Bestimmend für den Verlauf ist die Bildung der Kohlenstoff-Radikale, deren Stabilität in der Reihenfolge primär, sekundär, tertiär zunimmt. Im Gegensatz zum ionischen Mechanismus greift hier nicht zuerst der Wasserstoff (als Proton) sondern das Brom (als Atom = Radikal) an.
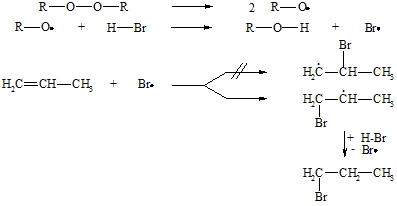
Weiterhin lassen sich C=C-Doppelbindungen mit Oxidationsmitteln angreifen. Hier kommen vor allem Ozon, Kaliumpermanganat, Kaliumdichromat und Wasserstoffperoxid in Frage. Mit Ozon reagieren sie nach einem komplizierten Mechanismus zu Aldehyden, die leicht weiter zu Carbonsäuren oxidiert werden, oder zu Ketonen. Hier soll nur die Reaktionsgleichung am Beispiel von 2-Methyl-but-2-en vorgestellt werden.
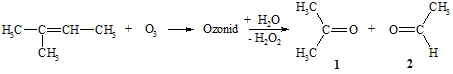
Bei dem ersten Teil der Reaktion des Alkens mit Ozon entsteht ein so genanntes Ozonid, das nicht isoliert sondern gleich hydrolysiert wird. Dabei entsteht Wasserstoffperoxid, das Aldehyde (hier: Acetaldehyd 2) zur entsprechenden Carbonsäure oxidiert. Formal wird bei dieser Reaktion die C=C-Doppelbindung vollständig gespalten, wobei eine C=O-Doppelbindung entsteht. Durch die Ozonolyse kann die Stellung von Doppelbindungen in Alkenen nachgewiesen werden indem die entstehenden Bruchstücke analysiert werden.
Bei der Oxidation eines Alkens mit Kaliumpermanganat werden je nach Reaktionsbedingungen unterschiedliche Produkte erhalten. Unter schonenden Bedingungen (0°C, schwach alkalisches Milieu) bleibt die Reaktion auf der Stufe eines Glycols (zwei Hydroxylgruppen an benachbarten Kohlenstoffatomen = vicinal) stehen, während in saurer Lösung das Glycol unter Spaltung der C-C-Bindung zwischen den Hydroxylgruppen weiter oxidiert wird, wobei Ketone oder Carbonsäuren entstehen.
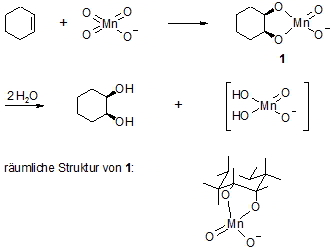
Obiger Reaktionsmechanismus erklärt auch die Tatsache, dass ausschließlich das cis-Produkt gebildet wird. Das Kaliumpermanganat greift die Doppelbindung von einer Seite unter Bildung eines nicht isolierbaren 5-Rings an. Das entstehende H2MnO4– ist unbeständig und disproportioniert zu MnO2 (Braunstein) und MnO4–.
Permanganat in saurer Lösung führt je nach den Substituenten, die die Doppelbindung trägt, über die Stufe des Glycols hinaus zur Carbonsäure bzw. zum Keton. Dabei wird wie bei der Ozonolyse die Doppelbindung vollständig gespalten. Bei obigem Ausgangsprodukt entsteht eine Dicarbonsäure, die Adipinsäure.
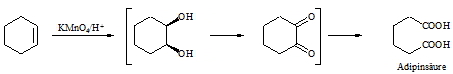
Anstelle von Kaliumpermanganat im sauren Medium kann man Alkene auch mit Kaliumdichromat oxidieren. Es entstehen hierbei die gleichen Produkte.
Die Oxidation von Alkenen mit Wasserstoffperoxid oder mit Persäuren führt zunächst zu Epoxiden (3-Ring-Ether), deren Ringöffnung trans-1,2-Dihydroxyverbindungen liefert.
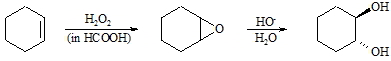
Die Angabe cis– und trans-Glycol hat bei Einsatz eines nicht cyclischen Alkens naturgemäß lediglich den Sinn, den Angriffsort der Reagenzien zu bezeichnen, da hier auf Grund der Rotationsmöglichkeit der gebildeten Einfachbindung keine cis– und trans-Isomeren isolierbar sind. Bei den Cycloalkenen entstehen jedoch unterschiedliche Isomere, da die Drehbarkeit der Bindung durch den Einbau in einen Ring aufgehoben ist.
Eine technisch bedeutende Reaktion ist die Polymerisation von Alkenen, die zu hochmolekularen Stoffen (Kunststoffe) führt. Bei dieser Kettenreaktion unterscheidet man zwischen anionischer, kationischer und radikalischer Polymerisation. Bestimmend für den Mechanismus ist die Natur des Kettenträgers.
Bei der radikalischen Polymerisation wird die Kettenreaktion mit Radikalbildnern, wie z.B. Peroxiden, gestartet. Kettenabbruch erfolgt durch Kombination zweier Radikale. Die Polymerisation des Ethens erfolgt unter hohem Druck bei 100°C. Das dadurch gebildete Polyethylen enthält 100 bis 1.000 Etheneinheiten.
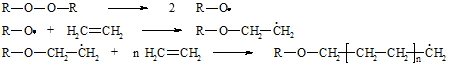
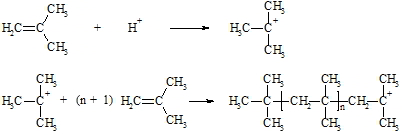
Bei der kationischen Polymerisation wird die Kettenreaktion häufig durch Protonen gestartet. Dabei entsteht ein Carbokation als Kettenträger. Reaktionstemperatur und Konzentration der Reaktanten regeln die Kettenlänge. Der Kettenabbruch erfolgt durch Aufnahme eines Anions oder durch Abgabe eines Protons an einem dem Kation benachbarten Kohlenstoffatom.
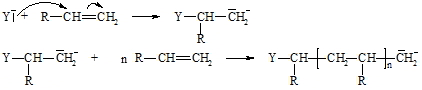
Bei der anionischen Polymerisation wird die Reaktionskette durch die Addition eines nucleophilen Agens (Y–) an die C=C-Doppelbindung des Alkens gestartet. Das dadurch gebildete Carbanion reagiert mit weiteren Alkenmolekülen (Kette) bis ein Abbruch durch Aufnahme eines Protons erfolgt. Nach diesem Schema reagieren meist nur solche C=C-Doppelbindungen, die durch Elektronen anziehende Gruppen aktiviert sind.
Die folgende Liste zeigt einige wichtige Kunststoffe, ihre monomeren Ausgangsstoffe sowie ihre typischen, immer wiederkehrenden Strukturelemente.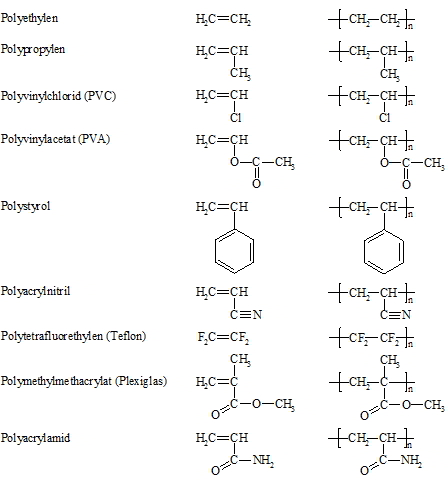
Bei der Polymerisation von Ethen fallen je nach Reaktionsbedingung (Druck, Temperatur) Polyethylene mit unterschiedlichen physikalischen Eigenschaften an. Polypropylen zeichnet sich durch hohe Härte und Wärmebeständigkeit aus. Polyvinylchlorid wird vielfältig eingesetzt. Trotz des aus ökologischen umstrittenen Images von PVC steigt die Verbrauchermenge ständig an. Bei der Verbrennung von PVC wird Salzsäure freigesetzt. Polyvinylacetat hat eine hohe Licht- und Witterungsbeständigkeit. Es findet Verwendung für Verpackungsfolien und für Beschichtungen von Papier und Lebensmitteln (Wurst- und Käsebeschichtungen). Polystyrol hat einen Molmassenbereich von 170.000 bis 1.000.000 g/mol. Es gilt als physiologisch unbedenklich und ist deshalb für Lebensmittelverpackungen zugelassen. Demgegenüber zeigt das Monomer (Styrol) im Tierversuch mutagene Eigenschaften. Der Verbrauch von Polystyrol erreichte 1989 in Westeuropa eine Menge von ca. 1.700.000 t, davon ca. 50% für Verpackungen, 15% für technische Teile, 14% für Haushalts- und Konsumwaren und 6% für Kühlgeräte. Haupteinsatzgebiet für Polyacrylnitril ist die Herstellung von Acrylfasern für Textilien. Polytetrafluorethylen besitzt eine äußerst hohe Beständigkeit gegen Chemikalien (z.B. Säuren, Laugen, organische Lösungsmittel) und wird deshalb häufig in chemischen Apparaturen verwendet. Weiterhin wird es eingesetzt als antiadhäsiver Überzug in der Papier-, Textil-, Nahrungsmittel- und Kunststoffverarbeitung. So sind z.B. Bratpfannen mit Teflon beschichtet. Der Kunststoff besitzt eine hohe thermische Beständigkeit. Die maximale Dauergebrauchs-Temperatur liegt bei 260°C. Bei Temperaturen oberhalb 400°C tritt jedoch Zersetzung auf wobei u. a. das äußerst toxische Fluorphosgen (COF2) entsteht. Polymethylmethacrylat ist ein amorpher, glasartig harter und transparenter Kunststoff. Es ist ein „organisches Glas“ das unter dem Namen Plexiglas bekannt ist. Polyacrylamid ist wichtig für die Gelelektrophorese, mit der z.B. Proteine getrennt werden können. Für die Herstellung des Gels wird ein Gemisch aus Acrylamid und N,N‘-Methylen-bis-acrylamid polymerisiert. Letztere Substanz dient dazu, die Polyacrylamid-Ketten untereinander zu verknüpfen. Näheres hierzu folgt im Kapitel 23.1 „Isolierung von Peptiden und Proteinen“.
Diene/Polyene
Befinden sich zwei C=C-Doppelbindungen in einem Molekül, so spricht man von einem Dien. Es folgen Triene, Tetraene usw., allgemein Polyene. Je nach Stellung der Doppelbindungen zueinander spricht man von kumulierten, konjugierten oder isolierten Doppelbindungen.
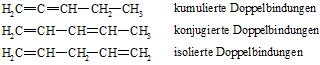
Die relative Lage der C=C-Doppelbindungen zueinander bestimmt die Eigenschaften der Verbindungen. Substanzen mit isolierten Doppelbindungen gleichen den Alkenen während die anderen ein unterschiedliches Verhalten zeigen. Konjugierte Diene gehen zwar auch Additionsreaktionen ein, sie können aber verschiedene Produkte bilden. Neben einer normalen 1,2-Addition gibt es auch eine 1,4-Addition. Im einem konjugierten Dien überlappen nicht nur die p-Orbitale von C-1 und C-2 sowie die von C-3 und C-4 sondern auch die von C-2 und C-3. Man hat also nicht eine Folge von Doppel-, Einfach-, Doppelbindung vorliegen sondern ein delokalisiertes System in dem die vier p-Elektronen über den Bereich der vier Kohlenstoffatome frei beweglich sind. Man spricht von Mesomerie.
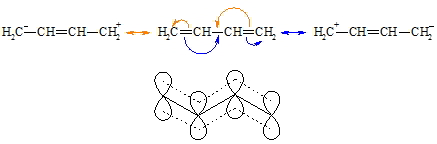
Durch den partiellen Doppelbindungscharakter der zentralen C-C-Bindung ist der Atomabstand von C-2 zu C-3 gegenüber einer normalen s-Bindung verringert. Weiterhin ist die freie Drehbarkeit der Bindung zwischen C-2 und C-3 eingeschränkt. Die Addition von z.B. Chlorwasserstoffsäure an ein konjugiertes Dien (hier: Butadien) führt, wie oben schon angedeutet, zu 1,2- (hier: 3-Chlor-but-1-en, 1) und 1,4-Additionsprodukten (hier: 1-Chlor-but-2-en, 2).
Das als Zwischenstufe gebildete Carbokation ist stabiler als beispielsweise das Ethylkation (CH3-CH2+), da die positive Ladung durch die benachbarte Doppelbindung delokalisiert ist. Die beiden in Klammer gezeichneten Formeln sind identisch; es handelt sich lediglich um mesomere Grenzstrukturen. Diese besitzen keine Realität. Der wirkliche Zustand eines mesomeren Systems liegt zwischen diesen Grenzstrukturen und ist nicht durch eine Strukturformel wiederzugeben. An die jeweils verbliebene Doppelbindung in 1 bzw. 2 kann nun noch ein zweites Molekül HCl addiert werden. Das Phänomen der Mesomerie wird im Kapitel 21. „Aromaten“ ausführlicher behandelt.
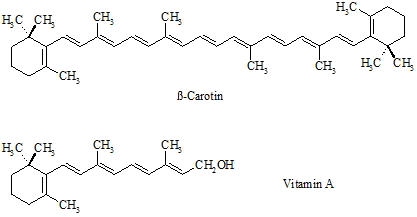
Polyene spielen bei ß-Carotin und verwandten Pflanzenfarbstoffen (Carotinoide) eine große Rolle. Im tierischen Organismus wird ß-Carotin enzymatisch in zwei Moleküle Vitamin A gespalten; man bezeichnet es deshalb auch als Provitamin A. Durch die große Anzahl von C=C-Doppelbindungen im Molekül ist das ß-Carotin farbig. Das delokalisierte p-Elektonensystem absorbiert einen Teil des für das menschliche Auge sichtbaren Spektrums. Die vom Auge wahrgenommene Farbe entspricht der jeweiligen Komplementärfarbe des absorbierten Spektralbereichs. Je stärker die p-Elektronen delokalisiert sind, d.h. je mehr konjugierte Doppelbindungen das Molekül hat, umso langwelliger (energieärmer) ist das Licht welches die Verbindung absorbiert.