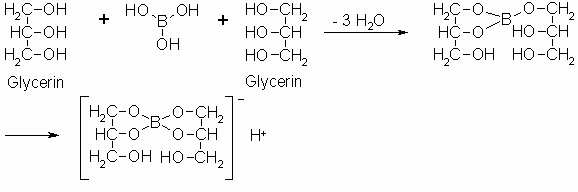Nomenklatur der Alkohole
Alkohole sind Derivate von Alkanen, bei denen ein Wasserstoffatom durch eine Hydroxylgruppe (-OH) ersetzt ist. Die Nomenklatur folgt der der Alkane und wird durch das Suffix –ol ergänzt. Höhere Alkohole tragen häufig historisch bedingte Trivialnamen (z.B. Laurylalkohol) was auch für andere, komplizierter aufgebaute Verbindungen gilt. Ab dem Propanol treten Strukturisomere auf.
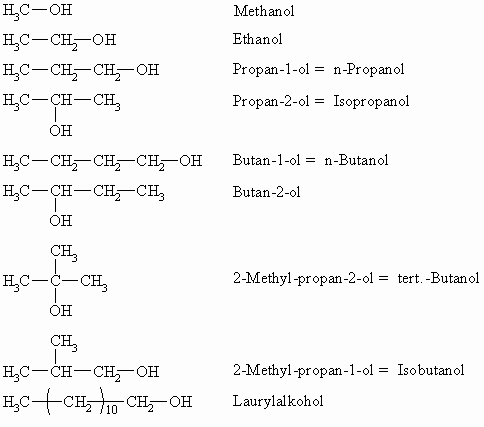
Nach der Stellung der Hydroxylgruppe unterscheidet man zwischen primären, sekundären und tertiären Alkoholen:
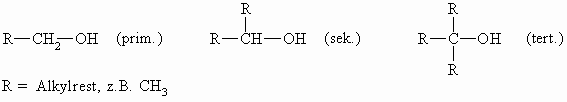
Neben diesen Alkoholen mit einer Hydroxylgruppe sind solche mit zwei, drei und mehreren Hydroxylgruppen bekannt. Man spricht von zwei-, drei- oder allgemein von mehrwertigen Alkoholen. Hier sind das Ethylenglycol (kurz: Glycol) und vor allem das Glycerin zu nennen. Letzteres ist ein sehr wichtiger Baustein für tierische Fette und pflanzliche Öle.

Eigenschaften von Alkoholen
Die Alkohole sind wesentlich weniger flüchtig als die Alkane mit vergleichbaren Molekulargewichten und leichter in Wasser löslich. Diese Unterschiede beruhen auf der Polarität der Hydroxylgruppe, die eine Assoziation der Alkoholmoleküle untereinander oder zum Wasser durch Wasserstoffbrücken bedingt. Alkohole zeigen eine strukturelle Ähnlichkeit zu Wasser. Formal ist ein Wasserstoff durch einen Alkylrest (R) ersetzt.
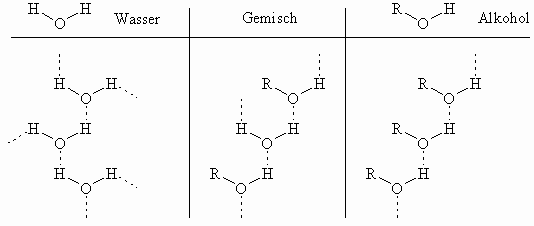
Wie oben erkennbar kann das Wasser aber mehr Wasserstoffbrücken als der Alkohol ausbilden. Dies macht sich durch stark unterschiedliche Siedepunkte bemerkbar: Wasser (MG 18) 100°C; Methanol (MG 32) 65°C. Zum Vergleich hat Methan (MG 16) einen Siedepunkt von –161°C. Beim Verdampfen der Flüssigkeit ist eine zusätzliche Energie aufzubringen, um die Wasserstoffbrücken aufzuspalten. Die Mischbarkeit der niederen Alkohole mit Wasser beruht auf der Fähigkeit, auch mit Wassermolekülen Wasserstoffbrückenbindungen einzugehen. Mit zunehmender Anzahl von Kohlenstoffatomen im Alkylrest des Alkohol wird der hydrophobe, wasserunlösliche Teil des Moleküls gegenüber der hydrophilen Hydroxylgruppe vergrößert. Folglich wird der Alkohol zunehmend schlechter in Wasser löslich. Methanol, Ethanol, beide Isomere des Propanols und tert.-Butanol sind in jedem Verhältnis mit Wasser mischbar. Butan-2-ol, Butan-1-ol und die höheren Alkohole zeigen zunehmend größere Mischungslücken. Die unterschiedliche Mischbarkeit der isomeren Butanole liegt an der Form und der Oberfläche der Moleküle; im tert.-Butanol ist der Alkylrest kugelig und im Butan-1-ol kettenförmig lang gestreckt.
Darstellung von Alkoholen
Methanol lässt sich durch trockene Destillation von Holz gewinnen (Holzgeist). 1 m³ Holz liefert 12 l Methanol. Dabei erhält man noch weitere Substanzen, wie z.B. Aceton. Bei der alkoholischen Gärung entsteht unter Einfluß von Enzymen aus Zucker Ethanol und Kohlendioxid.
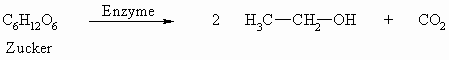
Alkohole lassen sich durch sauer katalysierte Addition von Wasser an Alkene nach der Markownikoff-Regel sowie durch Oxidation von Alkenen mit Kaliumpermanganat oder Wasserstoffperoxid (Produkte: 1,2-Diole) herstellen (siehe Kapitel „Alkene“). Ein weiterer Syntheseweg ist die in Kapitel „Reaktionen“ vorgestellte nucleophile Substitutionsreaktion. Ausgehend von Alkylhalogeniden läßt sich das Halogenid gegen ein Hydroxid-Ion austauschen. Man kann hier auch von einer alkalischen Hydrolyse des Alkylhalogenids (= Verseifung) sprechen.
![]()
Reaktionen von Alkoholen
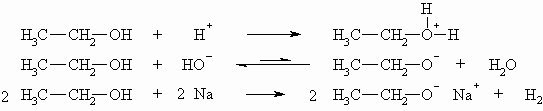
Wie das Wasser, besitzen Alkohole sowohl schwach basische als auch schwach saure Eigenschaften, d.h. sie können ein Proton aufnehmen oder abgeben. Da die Alkoholate (hier: Ethanolat CH3-CH2-O–) allerdings stärkere Basen als HO– sind, liegt das Gleichgewicht weitgehendst auf der Seite des Alkohols. Mit Hilfe von metallischen Natrium lassen sich aber Alkoholate quantitativ herstellen. Dabei wird das Natrium zu einem Kation oxidiert und das Proton der Hydroxylgruppe zu Wasserstoff reduziert, wobei letzterer gasförmig entweicht, so dass diese Reaktion nicht reversibel ist.
Die Protonierung der Hydroxylgruppe wurde schon bei der Eliminierungsreaktion (Kapitel „Alkene“ und „Reaktionen“) erwähnt und spielt auch bei der nucleophilen Substitutionsreaktion eine große Rolle. Das Hydroxid-Ion ist eine schlechte Austrittsgruppe während Wasser als neutrales Teilchen sehr leicht von einem Molekül abgespalten wird. So kann aus einem Alkohol ein Alken entstehen oder z.B. auch ein Alkylhalogenid.
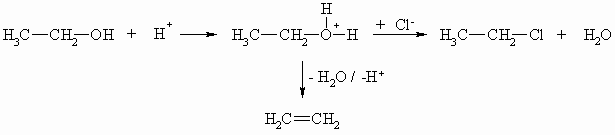
Bei der Eliminierung von Wasser aus z.B. Butan-2-ol können zwei isomere Alkene, But-1-en (1) und But-2-en (2) entstehen, je nach dem in welche Richtung die Reaktion abläuft.
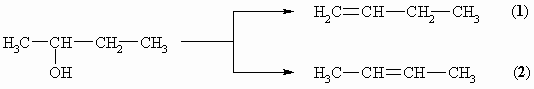
Das höher substituierte Alken (2) nennt man Saytzeff-Produkt, das andere (1) Hofmann-Produkt. Es bildet sich dabei überwiegend das thermodynamisch stabilere Saytzeff-Produkt. In diesem Beispiel entstehen 12% 1 und 88% 2. Das liegt daran, daß ein Proton von einem primären über einen sekundären zu einem tertiären Kohlenstoffatom zunehmend leichter abgespalten wird.
Die Oxidation primärer Alkohole (Dehydrierung = Abspaltung von Wasserstoff) führt zu Aldehyden, die eines sekundären Alkohols zu einem Keton. Tertiäre Alkohole lassen sich unter normalen Bedingungen gar nicht oxidieren.
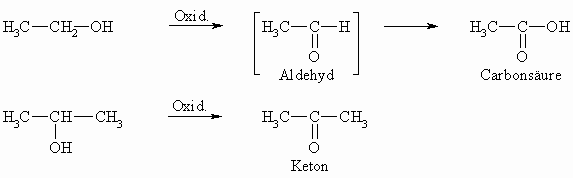
Da Aldehyde gegen Oxidationsmittel empfindlicher als Alkohole sind, kann man sie nur schwer abfangen; sie werden meist weiter zu Carbonsäuren oxidiert (siehe Kapitel „Carbonsäuren“). Als Oxidationsmittel kann man u.a. Kaliumdichromat (bzw. Kaliumchromat oder CrO3), Kaliumpermanganat im sauren Medium oder Iod im alkalischen Medium verwenden. Im folgenden Schema soll verdeutlicht werden, dass bei der Oxidation eines Alkohols mit Chromtrioxid zwei Elektronen vom Alkohol auf das Chrom übergehen, auch wenn die Richtigkeit dieses Mechanismus nicht geklärt ist.
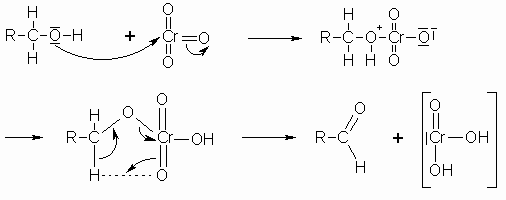
Die entstehende Chrom(IV)-Verbindung ist unbeständig und disproportioniert zu Chromtrioxid und Cr3+.
Iod in alkalischer Lösung oxidiert z.B. Ethanol zu Acetaldehyd, das dann weiter reagiert und Iodoform bildet. Hier soll nur der erste Teil der Reaktionsfolge interessieren. Die Folgereaktion (Iodoform-Reaktion) wird bei den Aldehyden in Kapitel „Carbonyle“ behandelt.
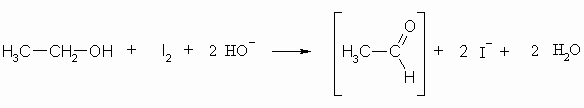
Mehrwertige Alkohole
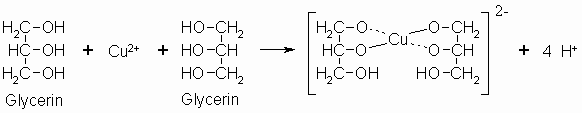
Die beiden wichtigsten mehrwertigen Alkohole, Ethylenglycol und Glycerin, wurden bei der Nomenklatur (Kapitel 6.1) schon vorgestellt. Die zwei bzw. drei Hydroxylgruppen befinden sich dabei an jeweils benachbarten Kohlenstoffatomen. Man spricht von einer vicinalen Stellung (von latein. vicinus = benachbart). Verbindungen mit zwei Hydroxylgruppen am selben Kohlenstoffatom (geminal, von latei. gemini = Zwillinge) sind zumeist unbeständig. Sie gehören auch nicht mehr zu den Alkoholen; es handelt sich um Derivate von Aldehyden und Ketonen. Cis-1,2-Diole bilden unter Abspaltung von vier Protonen mit Cu2+-Ionen einen Komplex, der so stabil ist, daß bei Zusatz von Natronlauge kein Kupferhydroxid gefällt wird. Eine entsprechende Reaktion spielt beim Nachweis von Aldehyden eine Rolle (Fehling-Reaktion, siehe Kapitel „Carbonyle“).
Ähnliche Komplexe entstehen auch mit Borsäure. Hierbei führt die Eigenschaft der Borverbindung als Lewis-Säure dazu, dass der Alkohol ein Proton am Sauerstoff abspaltet und merklich sauer reagiert. Damit verschiebt sich der pH-Wert durch diese Komplexbildung.