Aldehyde (von Alkohol dehydrogenatus) und Ketone enthalten als funktionelle Gruppe die polare Carbonylgruppe (C=O). Während bei den Aldehyden ein (oder bei Formaldehyd auch zwei) Wasserstoffatom am Carbonylkohlenstoff gebunden ist (–CHO), sind die nächsten Nachbarn der Carbonylgruppe in Ketonen nur Kohlenstoffatome.
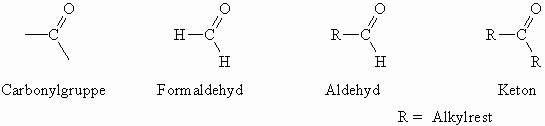
Nomenklatur der Aldehyde
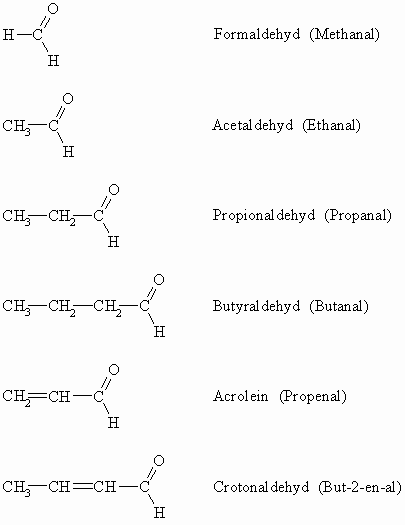
Aldehyde werden durch den Namen der Stammkohlenwasserstoffe, der das Suffix –al erhält, bezeichnet. Die Anfangsglieder der homologen Reihe der Aldehyde tragen allerdings Trivialnamen.
Nomenklatur der Ketone
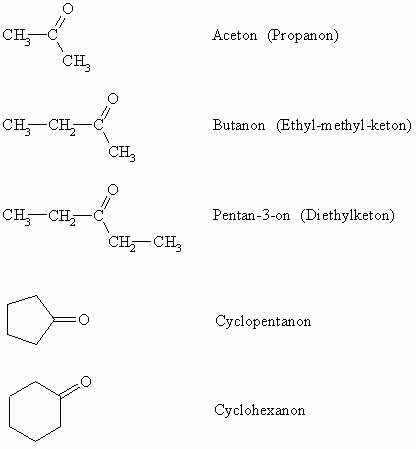
Ketone werden durch den Namen der Stammkohlenwasserstoffe, der das Suffix –on erhält, bezeichnet. Die Anfangsglieder der homologen Reihe der Ketone tragen allerdings Trivialnamen.
Darstellung von Aldehyden und Ketonen
Aldehyde und Ketone lassen sich hauptsächlich durch Oxidation von Alkoholen darstellen (vgl. Kapitel „Alkohole“). Dabei muss man bei Aldehyden von primären und zur Gewinnung von Ketonen von sekundären Alkoholen ausgehen. Da die Aldehyde gegen Oxidationsmittel empfindlicher sind als die Alkohole, muss man sie sofort nach ihrer Entstehung dem Reaktionsgemisch entziehen. Weiterhin entstehen Aldehyde und Ketone bei der Ozonolyse von Alkenen (siehe Kapitel „Alkene“) und bei der Addition von Wasser an Alkine (Kapitel „Alkine“).
Additionsreaktionen an die Carbonylgruppe
Die Reaktivität der Carbonylgruppe wird durch die unterschiedliche Elektronegativität der beiden Bindungspartner und die daraus resultierende Polarisation der C=O-Doppelbindung bedingt.
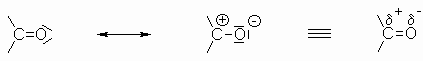
Dadurch kann der Carbonylkohlenstoff nucleophil und der Sauerstoff elektrophil angegriffen werden. Die Bereitschaft der Carbonylverbindung zu Additionsreaktionen nimmt in der Reihenfolge Formaldehyd, andere Aldehyde, Ketone ab. Diese Reaktion folgt dem allgemeinen Schema:
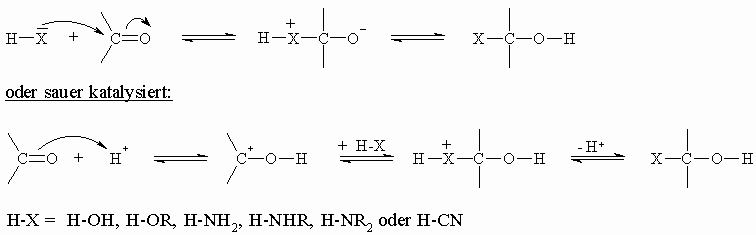
Das im obigen, allgemeinen Schema formulierte Produkt mit X und OH am selben Kohlenstoffatom ist meistens unbeständig und stabilisiert sich wie den folgenden Beispielen zu entnehmen ist.
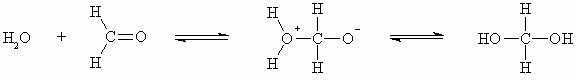
Bei der Addition von Wasser an eine Carbonylverbindung entstehen die meist unbeständigen und in die Ausgangssubstanzen zerfallende Hydrate. Nur in wässriger Lösung liegt z.B. der Formaldehyd als Hydrat (Formalin) vor:
Anstelle von Wasser kann auch ein Alkohol an Carbonylverbindungen addiert werden, wobei Halbacetale entstehen. Auch diese sind häufig unbeständig und zerfallen in ihre Ausgangssubstanzen.
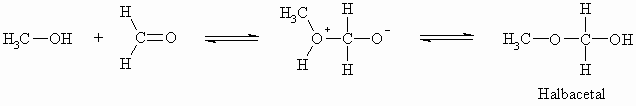
Diese Reaktion kann auch im sauren Medium durchgeführt werden, wobei die Reaktion weiter, über das Halbacetal hinaus, zum Acetal führt. Man nennt also Substanzen, die am selben Kohlenstoffatom eine OH-Gruppe und einen OR-Rest tragen Halbacetale und solche, die am selben Kohlenstoffatom zwei OR-Reste tragen Acetale. Diese Reaktion, die nicht nur die Aldehyde sondern auch die Ketone eingehen, ist bei den Zuckern (s. Kapitel „Kohlenhydrate“) von besonderer Bedeutung. Es soll hier noch betont werden, dass sich Acetale nur unter sauren Bedingungen bilden sowie in die Ausgangsverbindungen zerfallen. Gegenüber Alkalien sind sie sehr beständig. Wenn man von einem Keton ausgeht, nennt man die Produkte manchmal auch Halbketale (statt Halbacetale) bzw. Ketale (statt Acetale).
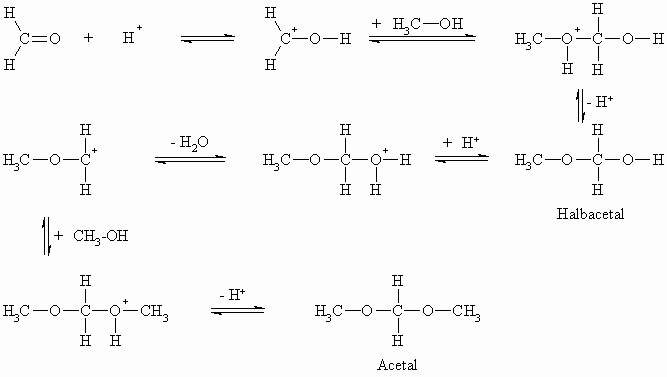
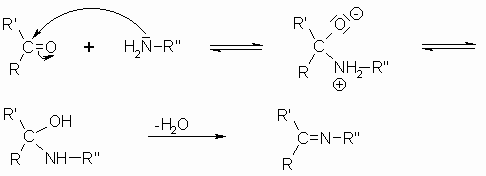
Die Umsetzung von Carbonylverbindungen mit Ammoniak führt zu einer instabilen Zwischenstufe mit geminaler OH- und NH2-Gruppe. Diese Verbindung stabilisiert sich unter Abspaltung von Wasser zu Iminen, die auch Schiff’sche Basen genannt werden. Da auch etliche andere stickstoffhaltige Substanzen wie Ammoniak reagieren, folgt hier erst der allgemeine Reaktionsmechanismus:
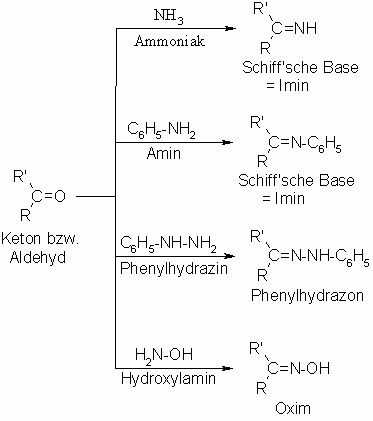
Aus primären Aminen (R‘‘ = Alkyl- oder Arylrest) entstehen Schiff‘sche Basen (= Imine), aus Phenylhydrazin (R‘‘ = C6H5-NH) Phenylhydrazone und aus Hydroxylamin (R‘‘ = OH) Oxime. Anstelle von Phenylhydrazin wird häufig dessen 2.4-Dinitro-Derivat verwendet, da dieses mit Aldehyden und Ketonen auch in stark saurer Lösung zu den entsprechenden 2.4-Dinitrophenylhydrazonen reagiert, die sich durch besonders gute Kristallisationsfähigkeit auszeichnen. Die 2.4-Dinitrophenylhydrazone haben eine gelbe bis orange Farbe.
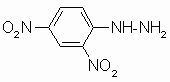
2.4-Dinitrophenylhydrazin
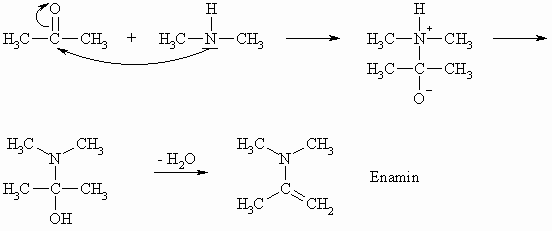
Bei der Umsetzung einer Carbonylverbindung mit sekundären Aminen kann sich das instabile Zwischenprodukt nicht durch Abspaltung von Wasser zum Imin C=N-Doppelbindung stabilisieren; dem System bleibt nur die Möglichkeit, Wasser unter Ausbildung eines Enamins (C=C-Doppelbindung) abzuspalten.
Die Addition von Blausäure an Carbonylverbindungen führt zur Ausbildung einer neuen C-C-Bindung wobei Cyanhydrine entstehen. Hier ist das Additionsprodukt stabil.
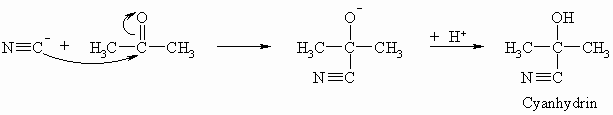
Cyanhydrine sind wichtige Ausgangsverbindungen für -Hydoxycarbonsäuren (s. Kapitel „Hydroxycarbonsäuren“) und eine analoge Reaktion hat Bedeutung für die Synthese von Aminosäuren (s. Kapitel „Aminosäuren“). Die Nitrilgruppe (-CN) läßt sich nämlich zur Carboxylgruppe (-COOH) hydrolysieren.
Die Addition von Wasserstoff an eine Carbonylgruppe ist eine Reduktion wobei die entsprechenden Alkohole entstehen. Diese Reaktion lässt sich katalytisch mit Wasserstoff oder mit Lithium-Aluminium-Hydrid durchführen.
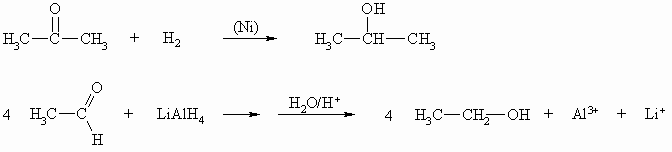
Bei Verwendung von Zink und Salzsäure wird der entstehende Alkohol weiter bis zum Alkan reduziert.
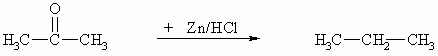
Oxidation von Aldehyden
Im Gegensatz zu Ketonen lassen sich Aldehyde oxidieren, wobei Carbonsäuren entstehen. Dies lässt sich nicht nur mit den schon mehrfach erwähnten Oxidationsmitteln wie Kaliumdichromat durchführen sondern auch mit Ag+– und Cu2+-Ionen. Da diese nur wenige andere Substanzen ebenfalls oxidieren, können diese Reaktionen als Nachweis für Aldehyde genutzt werden. Diese Nachweisreaktionen werden als Tollens- (Ag+) bzw. Fehling-Reaktion (Cu2+) benannt. Beide Reaktionen laufen nur im alkalischen Medium ab. Damit die Metall-Ionen aber nicht als Hydroxide ausfallen, müssen sie komplexiert (maskiert) werden. Dies erfolgt im Falle der Silber-Ionen mit Ammoniak als [Ag(NH3)2]+ und die Kupfer-Ionen werden mit einem Salz der Weinsäure als Komplex in Lösung gehalten (Kapitel „Alkohole“).
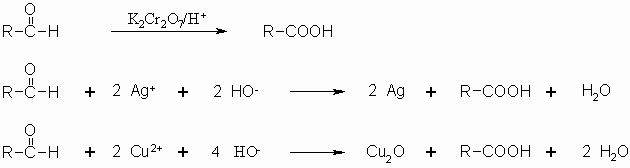
Die positive Reaktion ist daran zu erkennen, dass sich ein metallischer Silberspiegel an der Glaswand bildet bzw. daß rotes Kupfer-(I)-oxid ausfällt.
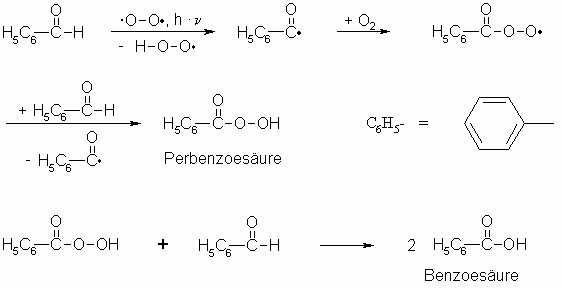
Verschiedene Aldehyde, z.B. der Benzaldehyd, unterliegen leicht der Autoxidation. Diese gleichfalls zu Carbonsäuren führende Reaktion folgt einem Radikalkettenmechanismus.
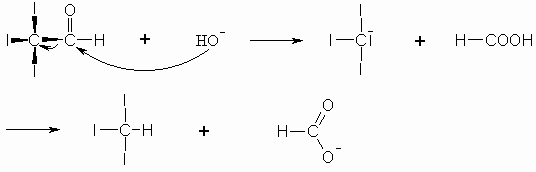
Formaldehyd und Aldehyde, die an dem zur Carbonylgruppe benachbarten Kohlenstoffatom (= -C-Atom) keinen Wasserstoff tragen, geben die Cannizzaro-Reaktion, d.h. sie disproportionieren in Gegenwart starker Basen zu den entsprechenden Säuren und Alkoholen. Die Anlagerung von HO– an den Aldehyd befähigt diesen, ein Proton und zwei Elektronen abzugeben. Von einem zweiten Aldehyd-Molekül werden diese aufgenommen.
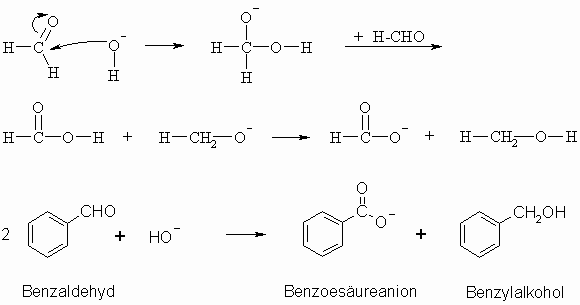
Trägt der -ständige Kohlenstoff ein Wasserstoffatom, so tritt nicht die Cannizzaro-Reaktion ein. Es findet dann die Aldol-Reaktion statt.
Polymerisation von Formaldehyd und Acetaldehyd
Die Polymerisation von Form- und Acetaldehyd führt zu linearen oder cyclischen Produkten. Der Formaldehyd geht mit sich selbst eine Polyaddition ein unter Bildung des Paraformaldehyds. Dieses ist ein in Wasser unlöslicher Kunststoff. Mit verdünnter Mineralsäure zerfällt er unter Bildung des kristallinen trimeren, cyclischen Formaldehyds, das Trioxan genannt wird.
Unter dem katalytischen Einfluß von Schwefelsäure trimerisiert auch der Acetaldehyd zum wasserlöslichen Paraldehyd.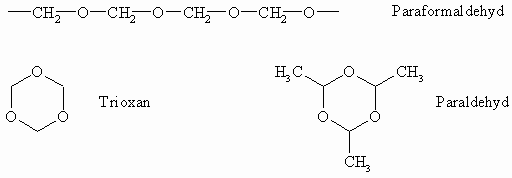
Keto-Enol-Tautomerie und CH-Acidität
Aldehyde und Ketone liegen im Gleichgewicht mit der tautomeren Enolform vor. Allerdings liegt das Gleichgewicht bei einfachen Carbonylverbindungen fast vollständig auf der Seite der Ketoform. Nur zu weit unter einem Prozent liegt die Enolform vor. Dies ändert sich bei ß-Diketonen und ß-Ketocarbonsäuren (s. Kapitel „Carbonsäuren“).
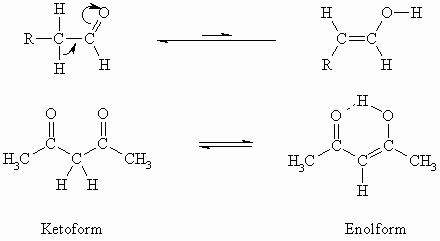
Die Konjugation der C=O- mit der C=C-Doppelbindung sowie die Wasserstoffbrücke sind energetische Faktoren, die bei letzterem die Ausbildung der Enolform begünstigen.
Wasserstoffe am -Kohlenstoffatom lassen sich durch starke Basen abspalten, da das entstehende Anion durch Mesomerie stabilisiert ist; man spricht von CH-aciden Verbindungen.
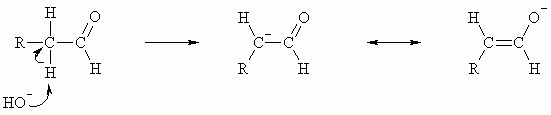
Das entstandene Anion ist nun zu weiteren Reaktionen befähigt. Ist kein weiteres Reagenz außer dem eingesetzten Aldehyd vorhanden, so reagiert das Anion mit diesem und es kommt zur sogenannten Aldolreaktion.
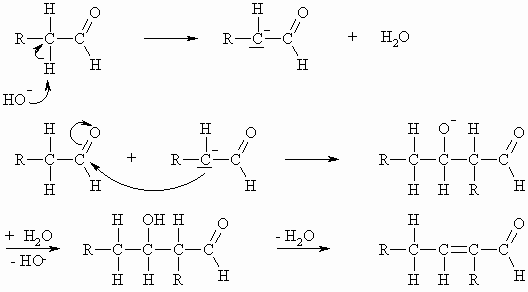
So entsteht beispielsweise aus Acetaldehyd über das Acetaldol (Aldoladdition) der Crotonaldehyd (Aldolkondensation). Die Aldole eliminieren sehr leicht Wasser, da dabei ein konjugiertes System entsteht.
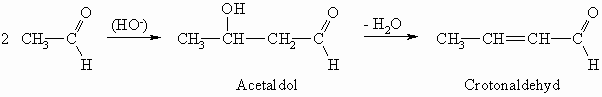
Eine analoge Reaktion werden wir bei den Carbonsäureestern unter dem Namen Claisensche Esterkondensation kennenlernen (s. Kapitel „Carbonsäurederivate“).
Acetaldehyd sowie Ketone, die eine CH3CO-Gruppe enthalten, geben die Iodoformprobe. Auch hier spaltet wie bei der Aldolreaktion die Base erst ein Proton am -Kohlenstoffatom ab. Das entstehende Carbanion greift jetzt allerdings kein zweites Molekül Aldehyd bzw. Keton an sondern das zugegebene Iod. So werden nacheinander alle Wasserstoffatome des -Kohlenstoffatoms gegen Iod ausgetauscht. Die elektronenziehende Wirkung (-I-Effekt) ist bei drei Iod-Resten groß genug, das I3C– zu stabilisieren und damit ist I3C– eine gute Abgangsgruppe; sie wird gegen OH– substituiert.
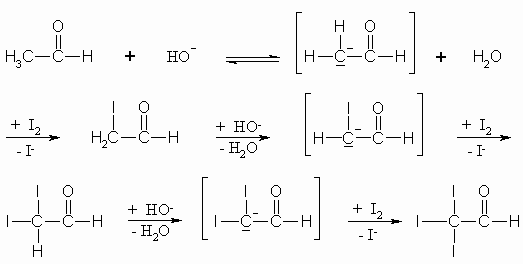
Das entstehende Iodoform hat eine gelbe Farbe und einen charakteristischen Geruch. Als Desinfektionsmittel ist es in weiten Bereichen der Medizin außerordentlich wichtig.