In den vorhergehenden Kapiteln sind verschiedentlich Reaktionen erwähnt worden, die sich unter bestimmten Sammelbegriffen zusammenfassen lassen. Es gibt beispielsweise die Additionsreaktionen, die Eliminierungsreaktionen und in den folgenden Kapiteln spielen die Substitutionsreaktionen eine wichtige Rolle. Die Beschreibung des Reaktionsablaufs, also die Angabe des Reaktionsmechanismus, sollte im Idealfall das Verhalten der an der Reaktion beteiligten Moleküle vor, während und nach der Umsetzung erklären. Da man die einzelnen Moleküle jedoch nicht beobachten kann, ist man auf makroskopische Aspekte (Zwischenstufen, Endprodukt) angewiesen aus denen man einen Mechanismus postuliert.
Additionsreaktionen
Die Additionsreaktion verläuft meist nach einen elektrophilen Mechanismus. Sie kann, vor allem bei den Alkinen, aber auch einem nucleophilen Mechanismus gehorchen. Entscheidend ist die Ladung des Teilchens, das im Primärschritt angelagert wird. Dies wurde in Kapitel „Alkene“ bei der kationischen bzw. anionischen Polymerisation schon gezeigt. Die elektrophile Addition wurde schon in den vorangehenden Kapiteln detailliert beschrieben, um zu erklären, dass bei der Bromaddition das trans-Produkt und bei der Oxidation mit Kaliumpermanganat aber das cis-Diol entsteht.
Eliminierungsreaktionen
Eliminierungsreaktionen wurden bereits bei der Darstellung von Alkenen und Alkinen erwähnt. Sie stellen die Umkehrung der Addition an eine Doppelbindung dar. Die Eliminierung von zwei Atomen oder Gruppen erfolgt meist von zwei benachbarten Kohlenstoffatomen (ß-Eliminierung).
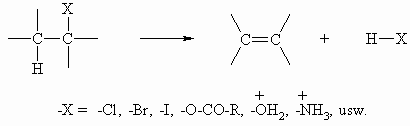
Die Eliminierung kann durch Säuren oder durch Laugen katalysiert werden. Dabei sind grundsätzlich zwei Wege möglich, je nachdem ob zunächst ein Carbokation gebildet wird oder ob die Abspaltung von H und X gleichzeitig erfolgt. Der Unterschied besteht darin, daß im langsamen Schritt der Reaktion entweder nur eine (Alkylhalogenid) oder zwei Substanzen (Alkylhalogenid und Hydroxid-Ion) beteiligt sind. Es liegt deshalb entweder eine Reaktion 1. Ordnung oder eine Reaktion 2. Ordnung vor (vgl. auch Kapitel 5.3). Dementsprechend unterscheidet man die beiden Mechanismen und spricht von einer E1- bzw. von einer E2-Reaktion. Die relative Stabilität des Carbokations ist durch seine Struktur bestimmt. Ist die positive Ladung an einem tertiären Kohlenstoffatom lokalisiert, dann kommt es durch den elektronendrückenden Effekt der drei Alkylreste zu einem teilweisen Ausgleich des Elektronendefizits. Ein derartiges Carbokation ist deshalb auch stabiler als, als wenn sich die positive Ladung an einem primären Kohlenstoffatom befindet.
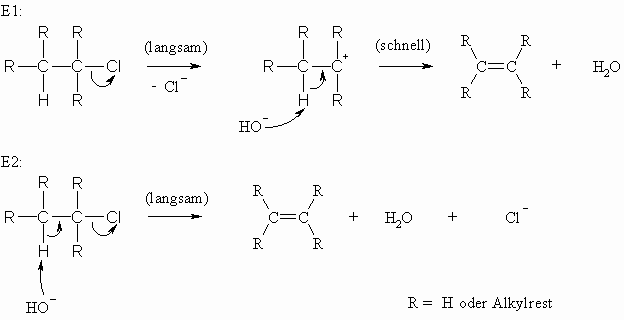
Nucleophile Substitutionsreaktionen
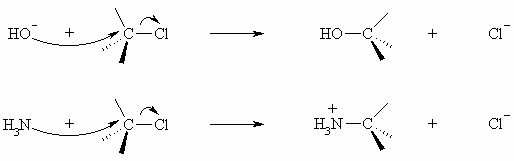
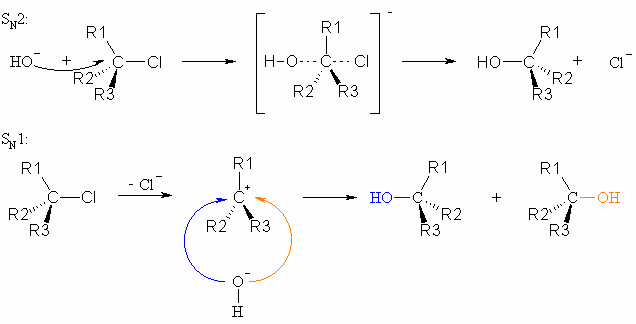
Die Bindung zwischen einem Kohlenstoffatom und einem elektronegativeren Partner, wie z.B. Halogen oder Sauerstoff ist durch das Auftreten partieller Ladungen charakterisiert. Diese Eigenschaft einer solchen Bindung führt also zu einem Elektronendefizit am Kohlenstoffatom, das dadurch relativ leicht von Anionen oder neutralen Molekülen, die ein freies Elektronenpaar besitzen, angegriffen werden kann. Dabei entsteht eine neue Bindung zu dem angreifenden Agens. Der alte Substituent wird abgespalten. Dieser Austausch wird als Substitution bezeichnet. Da das Agens mit einem freien Elektronenpaar am Kern des Kohlenstoffs angreift, spricht man von einer nucleophilen Substitution.
Für eine derartige Reaktion sind zwei Wege möglich. Im ersten Falle erfolgt der Angriff des Nucleophils (hier: HO–) und die Ablösung z.B. des Halogenidions gleichzeitig.
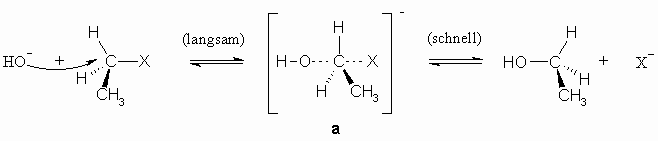
Bei diesem Reaktionsmechanismus wird ein nicht isolierbarer Übergangszustand (a) durchlaufen und das Energieprofil dieser Reaktion sieht wie folgt aus:
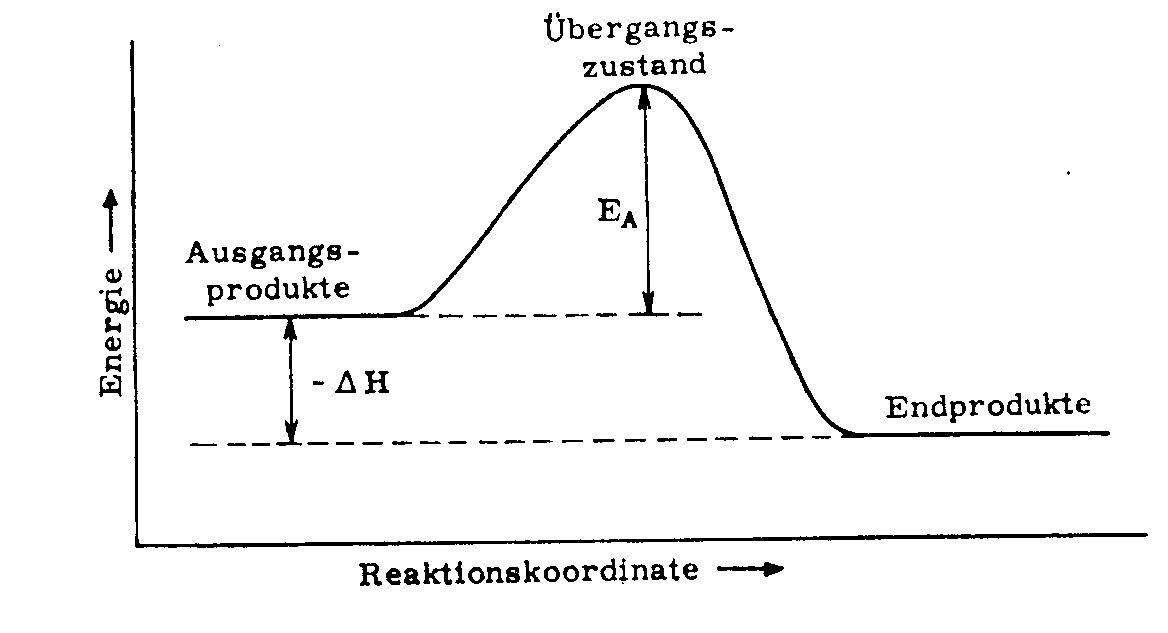
EA = Aktivierungsenergie
H = Energieunterschied zwischen Ausgangs- und Endprodukt
Übergangszustand: a
Der zweite Weg setzt eine langsam verlaufende Dissoziation z.B. der Kohlenstoff-Halogen- Bindung unter Bildung eines Carbokations (b) und eines Halogenidions voraus. Ist dieses Carbokation erst einmal entstanden, wird es schnell vom nucleophilen Agens (hier: HO–) angegriffen.
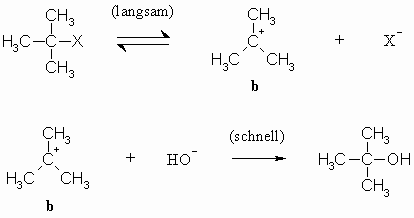
Bei diesem Reaktionsverlauf entsteht eine ionische Zwischenstufe (b) und das Energieprofil dieser Reaktion sieht wie folgt aus:
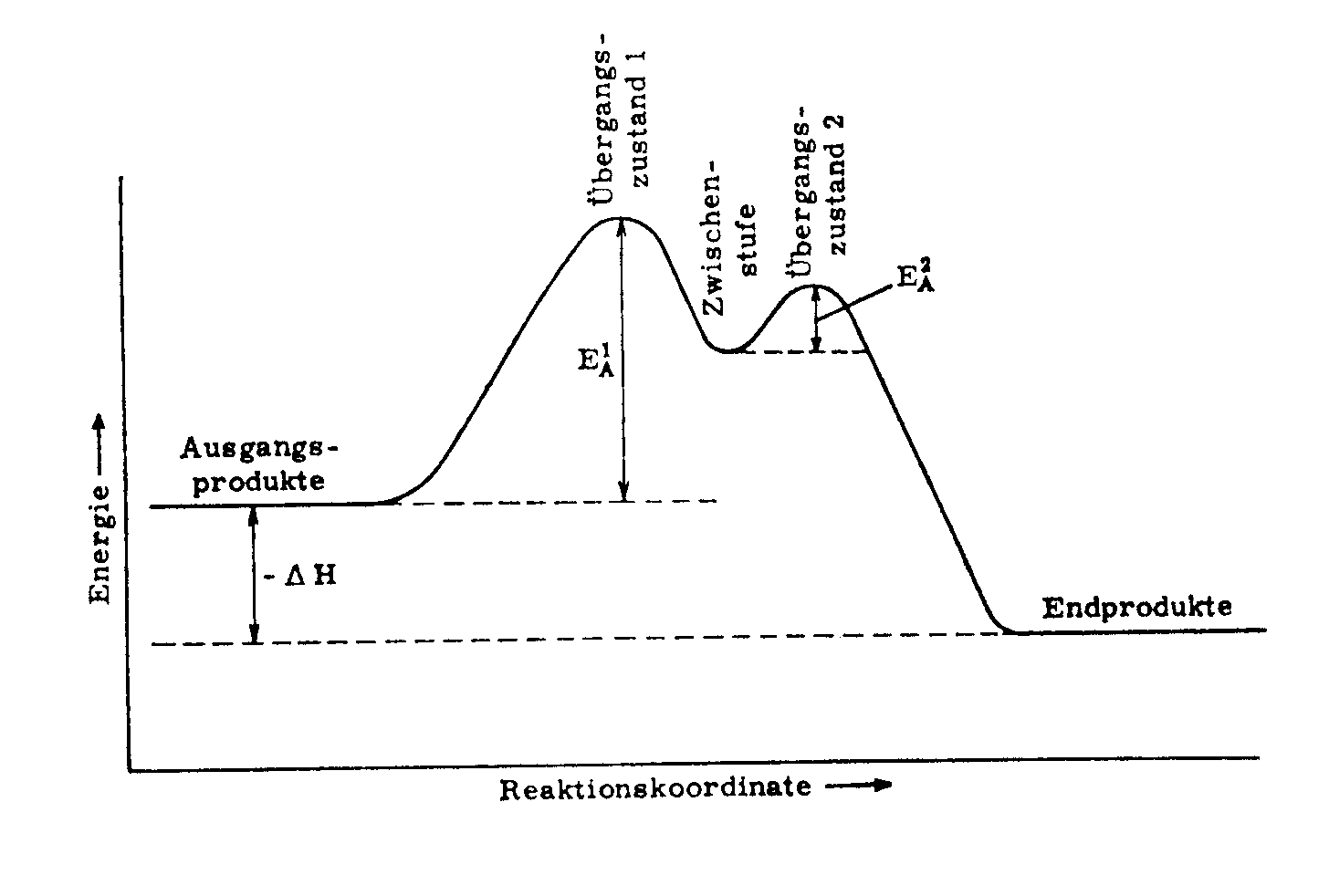
EA = Aktivierungsenergie
H = Energieunterschied zwischen Ausgangs- und Endprodukt
Zwischenstufe: b
Kinetische Messungen gestatten eine Unterscheidung zwischen diesen beiden Reaktionsmöglichkeiten, was auf unterschiedliche Reaktionsordnungen hinweist. Die Reaktionsordnung gibt an, wie viele Substanzen an dem für die Reaktionsgeschwindigkeit bestimmenden Teilschritt der Reaktion beteiligt sind. Die Reaktionsgeschwindigkeit ist von den Konzentrationen dieser Substanzen abhängig. So ist die Reaktionsgeschwindigkeit einer Reaktion erster Ordnung von der Konzentration einer Substanz (A)
v = k x [A] {v = Geschwindigkeit, k = Konstante}
und die einer Reaktion zweiter Ordnung von den Konzentrationen zweier Substanzen (A und B) abhängig
v = k x [A] x [B].
Im ersten Falle ist die Reaktionsgeschwindigkeit von der Konzentration beider Reaktionspartner (HO– und CH3-CH2-X) abhängig; es handelt sich somit um eine nucleophile Substitutionsreaktion zweiter Ordnung, abgekürzt SN2. Im zweiten Falle ist die Reaktionsgeschwindigkeit nur von der Konzentration von (CH3)3C-X abhängig und es liegt somit eine nucleophile Substitutionsreaktion erster Ordnung, abgekürzt SN1, vor. Die Konzentration von HO– spielt hier keine Rolle, da dieses erst im zweiten, schnellen Reaktionsschritt an der Reaktion teilnimmt.
Mit zunehmender Verzweigung des vom Nucleophil angegriffenen Moleküls (hier: Halogenid) tritt der SN1-Mechanismus in der Vordergrund:
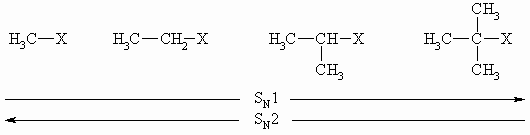
Dieses Ergebnis hängt damit zusammen, dass das Carbokation, das beim SN1-Mechanismus als Zwischenstufe entsteht, stärker durch Alkylreste (hier: CH3-Reste) als durch Wasserstoffe stabilisiert wird. Alkylreste wirken elektronendrückend und übernehmen damit einen Teil der positiven Ladung. Zusätzlich wird die Annäherung des Nucleophils an das Alkylhalogenid nach dem SN2-Mechanismus sterisch durch die größeren Alkylgruppen behindert.
Im SN2-Mechanismus kann sich das angreifende Nucleophil dem Alkylhalogenid aus sterischen und elektrostatischen Gründen nur von der dem Halogenatom abgewandten Seite nähern. Dieser Mechanismus ist deshalb mit einer Konfigurationsumkehr (Inversion, Waldensche Umkehr) verbunden. Der Kohlenstoff und die drei Reste R1, R2 und R3 liegen im Übergangszustand in einer Ebene. Sind die drei Reste unterschiedlich, so ist das Halogenid optisch aktiv (siehe Kapitel XX). Bei einem SN2-Mechanismus entsteht ein einheitliches Produkt. Demgegenüber kann das Nucleophil bei einem SN1-Mechanismus das als Zwischenstufe gebildete Carbokation, das ebenfalls planar aufgebaut ist, von beiden Seiten in annähernd gleicher Wahrscheinlichkeit angreifen. Dadurch entsteht ein Gemisch aus spiegelbildlichen Isomeren.
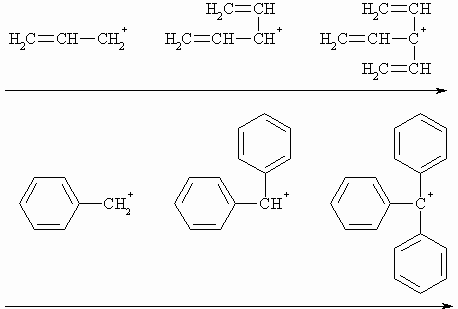
Konkurrenz zwischen Eliminierung und Substitution
Wann ein System lieber nach SN1 oder SN2 reagiert wurde schon zuvor angedeutet; es hängt von der Stabilität des beim SN1-Mechanismus als Zwischenstufe gebildeten Carbokations und von sterischen Faktoren ab. Je mehr Alkylreste am positiven Kohlenstoffatom gebunden sind, um so stabiler ist das Kation (für SN1) und um so stärker ist das Kohlenstoffatom im Ausgangsmolekül räumlich gegen einen Angriff des Nucleophils abgeschirmt (gegen SN2). Reste mit Doppelbindungen (Alken-, aromatische Reste) stabilisieren das Kation durch Mesomerie noch wesentlich stärker wobei die Stabilität in Richtung des Pfeiles zunimmt. Das heißt, Systeme mit solchen Resten reagieren immer lieber nach einem SN1-Mechanismus.
Während das angreifende Nucleophil bei einer SN1-Reaktion keinen Einfluß hat (es greift ja erst später in die Reaktion ein), ist der SN2-Mechanismus stark von dessen Nucleophilie, also der Bereitschaft ein Elektronenpaar für die neue Bindung zum Kohlenstoff zur Verfügung zu stellen, abhängig. Die Nucleophilie nimmt in folgender Reihenfolge zu:
F–, Cl–, Br–, I–, NO3–, H2O, CH3COO–, C6H5O–, HO–, CH3O–.
Alle nucleophilen Substitutionen sind vom verwendeten Lösungsmittel abhängig. Die durch das Lösungsmittel bedingte Solvatation ist bei Reaktionen nach dem SN1-Mechanismus wegen der ionischen Zwischenstufe besonders bedeutungsvoll, d.h. diese verlaufen besonders gut in polaren, protischen Solventien wie z.B. Wasser und Alkohol. Reaktionen nach dem SN2-Mechanismus werden dagegen von polaren, aprotischen Lösungsmitteln wie z.B. Ether und Aceton begünstigt, da hier zwar ein polarer Übergangszustand durchlaufen wird, aber keine Ionen gebildet werden.
SN1- und E1- bzw. SN2- und E2-Mechanismen besitzen jeweils eine gewisse Ähnlichkeit. Entsprechend laufen diese Reaktionen parallel in Konkurrenz zueinander ab. Ausgehend von tert.-Butylchlorid (1) entstehen deshalb 2-Methylbuten (2) nach einer E1-Reaktion und tert.-Butanol (3) nach einer SN1-Reaktion. Aus Chlorethan (4) werden Ethen (5) nach einer E2-Reaktion und Ethanol (6) nach einer SN2-Reaktion gebildet.
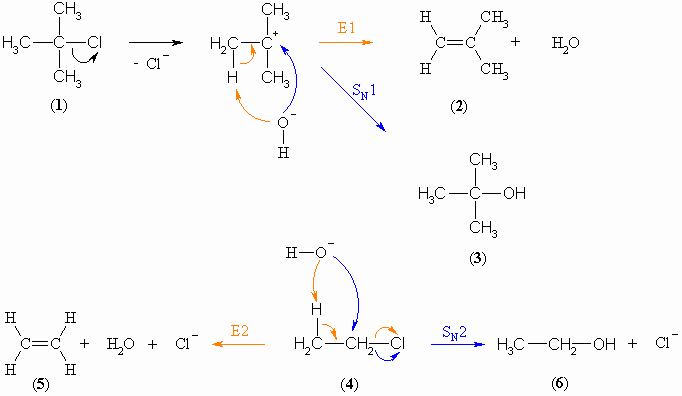
Wie bei der Substitution spielt das Nucleophil bei der Eliminierung nur bei der Reaktion zweiter Ordnung eine Rolle. Starke Basen begünstigen die E2-Reaktion gegenüber derSN2-Reaktion. Bei höheren Temperaturen wird das Eliminierungsprodukt verstärkt gebildet und umgekehrt begünstigen tiefere Temperaturen die Substitutionsreaktion.
Abschließend drei Beispiel für das Verhältnis von Substitutions- zu Eliminierungsprodukt:
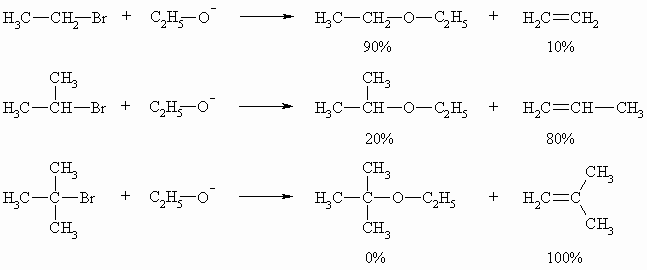
Die große und starke Base, Ethanolat, greift mit zunehmender sterischer Abschirmung des Kohlenstoffatoms, das das Brom bindet, bevorzugt ein Proton an der Peripherie an, was zur Eliminierung, also zur Bildung eines Alkens führt. Das Substitutionsprodukt, ein Ether wird im letzten Fall gar nicht mehr gebildet.
Weitere Beispiele für Substitutionsreaktionen werden in den folgenden Kapiteln beschrieben.