Nomenklatur der Alkylhalogenide
Bei den Alkylhalogeniden, die auch Halogenalkane genannt werden, sind formal ein oder mehrere Wasserstoffatome eines Alkans gegen Halogenatome ausgetauscht. Die Benennung der Alkylhalogenide erfolgt durch voranstellen des Halogens (mit Anzahl falls mehr als eins) vor den Namen des zugrunde liegenden Alkans.

Entsprechend werden auch die Fluor-, Brom- und Iod-Verbindungen benannt. Einige der alten Namen wie Chloroform, Vinylchlorid und Allylchlorid haben sich hartnäckig im Sprachgebrauch erhalten.
Eigenschaften von Alkylhalogenide
Alkylhalogenide sind polare aber nicht hydrophile Substanzen. Sie mischen sich nicht mit Wasser. Die Kohlenstoff-Halogen-Bindung ist, wie schon erwähnt wurde, polarisiert aber nicht ionisch. Nach den bei den Kohlenwasserstoffen angeführten Gesetzmäßigkeiten folgt auch hier, dass die Siedepunkte der homologen 1-Halogenalkane mit zunehmender Länge der Kohlenwasserstoffkette ansteigt. Bei einem gegebenen Kohlenwasserstoffrest werden ferner die Siedepunkte der Halogenderivate mit zunehmendem Atomgewicht des Halogens erhöht, und bei isomeren Alkylhalogeniden gilt die allgemeine Regel, daß der Siedepunkt mit steigendem Verzweigungsgrad fällt.
Die Alkylhalogenide spielen eine sehr große Rolle als Lösungsmittel und Reagenzien für chemische Synthesen. Die Halogenderivate des Methans besitzen meist eine hohe Toxizität. Chlormethan ist ein Stoffwechselprodukt von Organismen im Meer, aus dem jährlich etwa 5.000.000 t an die Atmosphäre abgegeben werden. Auch Bromoform, CHBr3, kommt im Meerwasser als Stoffwechselprodukt der Algen vor. Chloroform wurde früher als Anästhetikum verwendet, wird aber heute wegen seiner Toxizität durch andere Substanzen ersetzt. Bemerkenswert ist auch, dass sich Chloroform bei längerem Stehenlassen an feuchter Luft, vor allem im Licht, unter Bildung des äußerst giftigen Phosgens, COCl2, zersetzt. Daher bewahrt man Chloroform in braunen Flaschen auf. Chlorethan kann als Lokalanästhetikum (Vereisung) bei Sportverletzungen und kleinen Operationen benutzt werden. Iodoform, CHI3, wurde früher in der Wundbehandlung als Antisepticum verwendet, heute wird es aber kaum noch gebraucht. In größeren Mengen von Wundflächen resorbiert, kann es zu manischen Zuständen mit Delirien, Schlaflosigkeit, Krämpfen und Lähmungen kommen. Einige Fluorchlorkohlenwasserstoffe der Methan- und Ethanreihe (FCKW), die wegen ihres niedrigen Siedepunktes, ihrer Ungiftigkeit und chemischen Widerstandsfähigkeit als Kältemittel für Kühlschränke und Klimaanlagen, als Treibmittel für Aerosole und Plastikschäume sowie zur chemischen Reinigung geeignet sind, werden zunehmend durch andere Verbindungen ersetzt, da sie aufgrund ihrer chemischen Stabilität und ihrer großen Flüchtigkeit in höhere Schichten der Atmosphäre, die Stratosphäre, gelangen und dort mit Ozon reagieren, z.B.:
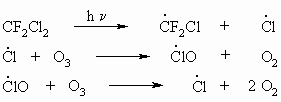
Darstellung von Alkylhalogeniden
Die Möglichkeiten zur Synthese von Alkylhalogeniden wurden schon besprochen, so die radikalische Halogenierung von Alkanen (Kapitel „Alkane“), durch Additionsreaktionen an Alkene (Kapitel „Alkene“) und durch nucleophile Substitution aus Alkoholen (Kapitel „Reaktionsmechanismen“). Die Geschwindigkeit der Reaktion eines vorgegebenen Alkohols nimmt in Abhängigkeit von der Halogenwasserstoffsäure in der Reihenfolge HF, HCl, HBr, HI zu. Zur Unterscheidung primärer, sekundärer und tertiärer Alkohole kann man die unterschiedliche Substitutionsgeschwindigkeit ausnutzen. Bei tertiären Alkoholen bildet sich das Alkylhalogenid sofort, sekundäre Alkohole reagieren erst nach einigen Minuten und primäre müssen erhitzt werden.
Reaktionen von Alkylhalogeniden
Die typischen Reaktionen der Alkylhalogenide sind vom Typ der Eliminierung und der nucleophilen Substitution. Diese wurden bei den Darstellungen von Alkenen (Kapitel „Alkene“), Alkinen („Alkine“), Alkoholen („Alkohole“) und Ethern („Ether“) schon behandelt. Zum Nachweis von Alkylhalogeniden dient die Beilstein-Probe. Erhitzt man die Probe auf einem Kupferdraht, so färbt sich die Bunsenbrenner-Flamme durch das verdampfende Kupferhalogenid grün.