Die große Vielfalt der im lebenden Organismus vorkommenden Eiweißkörper baut sich aus Aminosäuren (s. Kapitel 18) auf. Diese sind die weitaus wichtigsten Bausteine des Körpers: Serumalbumin und –globulin (im Blutserum), Myosin (im Muskel), Hämoglobin, Kollagen (Bindegewebsprotein), Keratin (Haare, Wolle), Enzyme usw. Auch die Bakterientoxine wie z.B. das Tetanustoxin und die Schlangengifte sind Eiweißkörper. Peptide und Proteine unterscheiden sich in ihrer Größe; Bei einem Molekül, das aus zwei bis zehn Aminosäureresten aufgebaut ist spricht man von einem Oligopeptid, darüber hinaus bis zu 100 Aminosäureresten von Polypeptiden und größere Verbindungen nennt man Proteine.
Die Aminosäuren sind in den Peptiden und Proteinen durch Säureamidbindungen (hier Peptidbindungen genannt) miteinander verbunden.
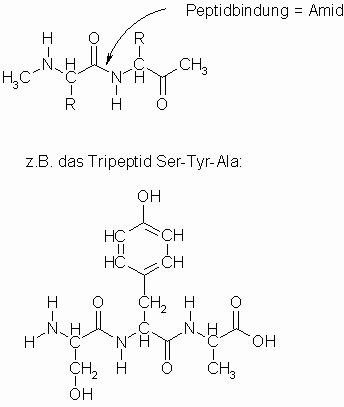
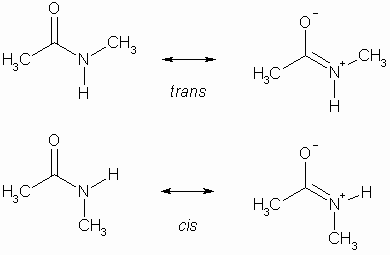
Dabei hat die Peptidbindung durch Mesomerie einen partiellen Doppelbindungscharakter, sodass es zu einer cis– oder trans-Anordnung kommen kann.
Aus zwei Aminosäuren, z.B. Glycin und Alanin, können die zwei isomeren Dipeptide Gly-Ala und Ala-Gly entstehen. Dazu kommen dann noch die Kombinationen Gly-Gly und Ala-Ala. Bei drei Aminosäuren gibt es schon sechs isomere Tripeptide; neben dem oben abgebildeten Ser-Tyr-Ala gibt es noch Ser-Ala-Tyr, Tyr-Ser-Ala, Tyr-Ala-Ser, Ala-Ser-Tyr und Ala-Tyr-Ser. Diese Zahl der Tripeptide erhöht sich erheblich, wenn eine der drei Aminosäuren zwei- oder dreimal enthalten ist und dafür eine oder beide anderen fehlen. Berücksichtigt man nun noch, dass Peptide und Proteine aus etwa 20 verschiedenen Aminosäuren aufgebaut sind, kann man leicht erahnen, welche ungeheure Vielzahl von Verbindungen möglich ist.
Bei der Struktur eines Eiweißkörpers sind vier Faktoren zu berücksichtigen:
- Die Primärstruktur gibt die Anzahl und die Sequenz der einzelnen Aminosäuren in der Proteinkette an.
- Die Sekundärstruktur gibt Auskunft über die sterische Anordnung der einzelnen Aminosäuren in der Kette, also z.B. die Form der Helix oder des Faltblattes.
- Die Tertiärstruktur ist die Gesamtstruktur des Moleküls im Raum.
- Die Quartärstruktur gibt die räumliche Lage mehrerer Moleküle zueinander an.
In der α-Helix ist die Peptidkette schraubenfederartig aufgewunden und umschreibt eine zylinderartige Struktur.
Diese Struktur wird durch intramolekulare Wasserstoffbrücken-Bindungen zwischen zwei Peptidbindungen (von C=O nach H-N) ausgebildet. Sie sind in obiger Zeichnung (rechte Struktur) punktiert eingezeichnet. Die zum Teil recht großen Reste (R) der Aminosäuren ragen senkrecht zum Zylinder der Helix-Struktur heraus, wo sie am wenigsten zu sterischen Wechselwirkungen führen. Aus sterischen Gründen wird die Helix durch Prolin und Hydroxyprolin (sekundäre Amine mit Stickstoff in einem Fünfring) in der Sequenz gestört. Die a-Helix wurde zuerst für die Struktur des a-Keratins, also die Proteine der Haut, Haare, Wolle, Nägel, Krallen und Hufe nachgewiesen.
Die maximale Anzahl von Wasserstoffbrücken kann sich auch zwischen zwei antiparallel nebeneinander liegenden, gestreckten Polypeptidketten ausbilden.
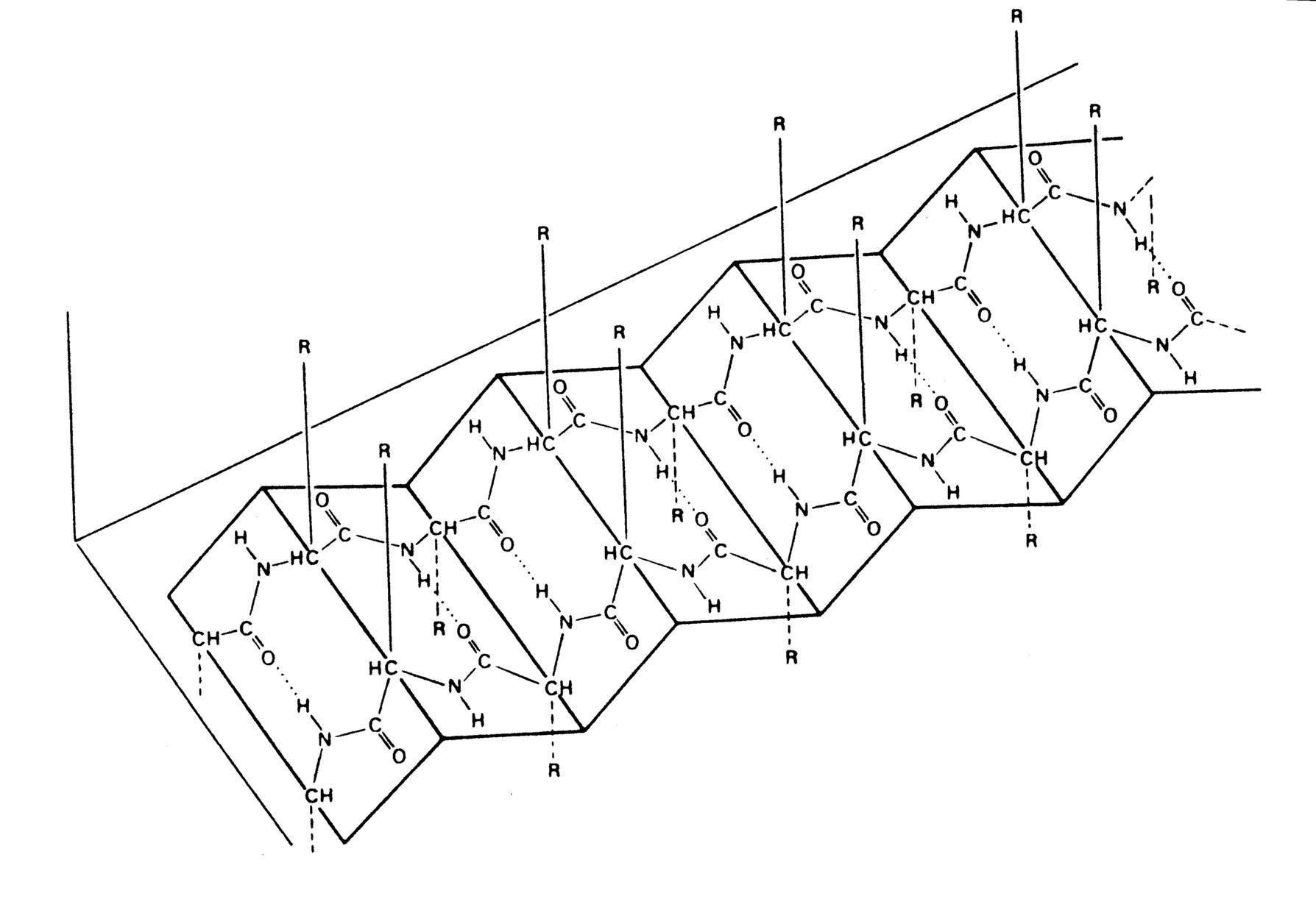
An allen a-Kohlenstoffatomen ist die Kette gefaltet; die dazwischen liegenden Bereiche, also die Peptidbindung mit ihren benachbarten Atomen, ist planar angeordnet. Die Seitenketten der einzelnen Aminosäuren ragen nahezu senkrecht nach oben bzw. nach unten aus der Faltblattfläche heraus, was ebenfalls zu einer geringen sterischen Belastung führt.
Die Tertiärstruktur eines Proteins wird durch Wechselwirkungen stabilisiert, die sich zwischen zum Teil auch weit voneinander entfernten Aminosäuren ausbilden. Hieran sind Wasserstoffbrücken-Bindungen (1), Disulfidbrücken (2), Ionenbindungen (3) und van der Waals Wechselwirkungen zwischen hydrophoben Gruppen (4) beteiligt, wie das folgende Schema zeigt.
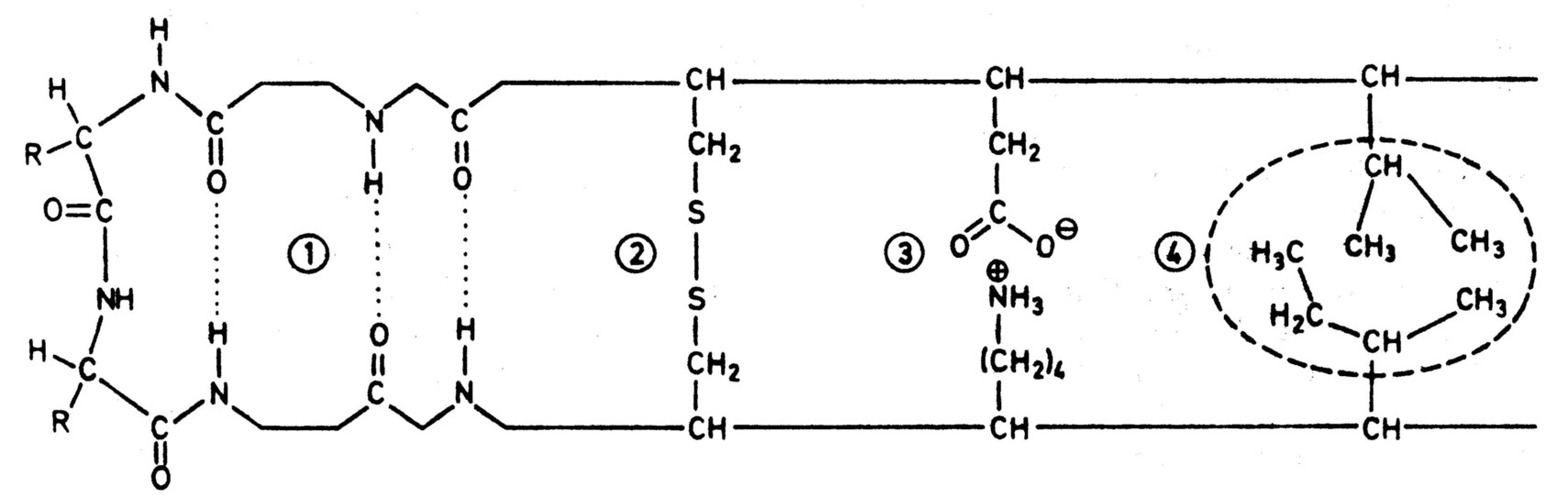
Im Folgenden sollen die Strukturen einiger Proteine und Peptide vorgestellt werden:
a) Primärstrukturen von Ocytocin und Vasopressin:
Bei diesen Hypophysenhinterlappenhormonen handelt es sich um Oligopeptide mit jeweils neun Aminosäureresten, also um Nonapeptide.

Die Primärstrukturen beider Verbindungen unterscheiden sich nur in zwei Aminosäureresten. Der Name „Ocytocin“ kommt aus dem griechischen (oxys = schnell und tokos = gebären), da diese Substanz im Säugetierorganismus kontraktionsauslösend auf die glatte Muskulatur der Uterus wirkt. Näheres erfahren Sie im 3. Semester im Fach Embryologie. „Vasopressin“ leitet sich vom lateinischen vas = Blutgefäß und pressus = Druck ab; es hat eine antidiuretische und Blutdruck erhöhende Wirkung.
b) Primärstruktur von Insulin:

Das Insulin wird in den Langerhansschen Inseln der Bauchspeicheldrüse (Pankreas) gebildet. Es reguliert den Blutzuckerspiegel. Mangelnde oder fehlende Insulinproduktion führt zum Diabetes mellitus. Zur Therapie dieser Krankheit wird Insulin verwendet. Dieses besteht aus zwei Ketten, die über zwei Disulfidbrücken miteinander verbunden sind. Die A-Kette besteht aus 21, die B-Kette aus 30 Aminosäuren. Die Insuline des Menschen und verschiedener Tierarten zeigen zwar Unterschiede in der Primärstruktur, aber kaum in ihrer biologischen Wirkung. Obige Struktur zeigt das Insulin des Rinds, das mit dem der Ziege identisch ist. In der folgenden Tabelle sind die Variationen in der Aminosäuresequenz einiger Insuline aufgelistet:
| Spezies | A-Kette Position 8-9-10 | B-Kette Position 30 |
| Mensch | Thr-Ser-Ile | Thr |
| Schwein, Hund, Potwal | Thr-Ser-Ile | Ala |
| Kaninchen | Thr-Ser-Ile | Ser |
| Rind, Ziege | Ala-Ser-Val | Ala |
| Schaf | Ala-Gly-Val | Ala |
| Pferd | Thr-Gly-Ile | Ala |
| Blauwal | Ala-Ser-Thr | Ala |
c) Primärstruktur von Glucagon (Schwein):
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr
Das Glucagon ist auch an der Steuerung des Glucosehaushalts beteiligt. Das Schweineglucagon ist ein lineares Peptid aus 29 Aminosäuren. Auch hier gilt, dass die Aminosäuresequenz bei den einzelnen Säugetierspezies nur geringfügige Abweichungen zeigen.