Nomenklatur der Alkine
Alkine sind Kohlenwasserstoffe mit CC-Dreifachbindungen. Ihre Nomenklatur leitet sich wie die der Alkene von den Alkanen ab. Anstelle der Endsilbe –an tritt das Suffix –in. Die allgemeine Summenformel für ein einfaches Alkin ist CnH2n-2.
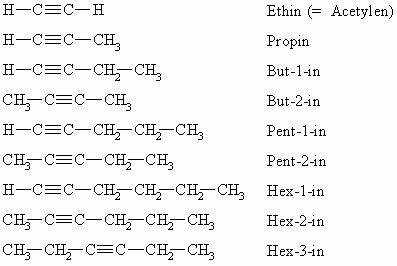
Die beiden Kohlenstoffe an der Dreifachbindung sind sp-hybridisiert, d.h. sie haben zwei Hybridorbitale und zwei p-Orbitale. Die beiden Hybride sind linear angeordnet, d.h. sie schließen einen Winkel von 180° ein. Die zwei p-Orbitale stehen senkrecht zu dieser Linie und auch senkrecht zueinander. Je eines der beiden Hybridorbitale von zwei Kohlenstoffatomen bildet die -Bindung und die p-Orbitale führen zu zwei -Bindungen. Das zweite Hybridorbital bindet ein weiteres Atom (C oder H). Das hat zur Folge, daß der Bereich der Dreifachbindung mit den nächsten Nachbarn (C-CC-C) linear aufgebaut ist. Somit gibt es bei den Alkinen keine cis–trans-Isomerie.
Darstellung von Alkinen
Wie die Alkene lassen sich die Alkine durch Eliminierungsreaktionen herstellen. Jedoch muß hier aus einem Dihalogenalkan eine zweifache Abspaltung von Halogenwasserstoffsäure erfolgen.
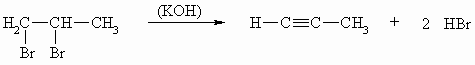
Ethin (alter Name: Acetylen) kann auch durch Hydrolyse von Calciumcarbid hergestellt werden. Früher wurde diese Reaktion in sogenannten Carbidlampen durchgeführt und das entstandene Ethin zur Lichtgewinnung verbrannt. Calciumcarbid wird auch zur Vertreibung von Wühlmäusen verwendet.
![]()
Reaktionen von Alkinen
Das Ethin brennt mit stark rußender Flamme. Bei der Verbrennung von Ethin-Sauerstoff-Gemischen werden Temperaturen bis zu 3100°C erreicht, was man sich beim autogenen Schweißen zu Nutze macht.
![]()
Die Dreifachbindung der Alkine besitzt ähnliche Eigenschaften wie die Doppelbindung, so dass die Reaktionstypen der Alkene auch bei dieser Verbindungsklasse, wenn auch meist in etwas abgewandelter Form, beobachtet werden. So lässt sich die Dreifachbindung katalytisch über das Alken zum Alkan hydrieren. Unter geeigneten Bedingungen ist es auch möglich, diese Reaktion auf der Stufe des Alkens zu beenden.
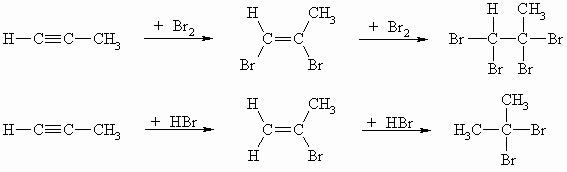
Die CC-Dreifachbindung geht auch die elektrophilen Additionsreaktionen ein. Die Addition von der Halogene und der Halogenwasserstoffe erfolgt in zwei Stufen.
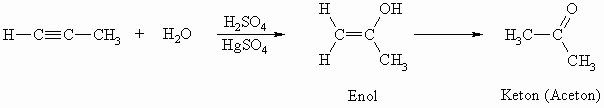
Bei der Addition von Wasser in Gegenwart einer Säure und Quecksilber(II)-Ionen als Katalysator wird, wie erwartet, das erste Wassermolekül angelagert wobei ein sogenanntes Enol entsteht. Dieses lagert sich jedoch sofort zu einem Aldehyd bzw. Keton um, so dass kein zweites Wassermolekül addiert wird. Diese Umlagerung, die man Tautomerie nennt, wird in Kapitel „Aldehyde und Ketone“ ausführlich behandelt.
Alkine mit einer endständigen CC-Dreifachbindung (also 1-Alkine) bilden mit starken Basen salzartige Verbindungen, sogenannte Acetylide. Die Acidität dieser Alkine beruht auf der besonderen Struktur der C-H-Bindung; bei einem sp-Hybrid ist der s-Charakter größer als bei sp2– oder sp3-hybridisierten Kohlenstoffatomen.
![]()
Bei den Acetyliden handelt es sich nicht um echte Salze. Sie haben keine Ionen- sondern eine polarisierte, kovalente Bindung wie oben angedeutet. Schwermetallacetylide sind explosiv und farbig.