Die Kohlenhydrate sind im pflanzlichen und tierischen Organismus weit verbreitet und gehören zu den wichtigsten Naturstoffen. Die Bezeichnung „Kohlenhydrat“ beruht auf ihrer allgemeinen Summenformel Cn(H2O)m. Sie werden auch als Zucker oder Saccharide (griech. Zucker) bezeichnet. Diese Elementarzusammensetzung war schon Ende des 18. Jahrhunderts bekannt. Erste Berichte über die Abtrennung von Milchzucker aus der Milch datieren aus dem 16. Jahrhundert. Die Grundlage der Chemie der Kohlenhydrate erbrachte Emil Fischer zwischen 1884 und 1919.
Die Kohlenhydrate werden von grünen Pflanzen durch Photosynthese aus Kohlendioxid und Wasser aufgebaut. Die vereinfachte Summenreaktionsgleichung dafür lautet:
![]()
In der Klasse der Kohlenhydrate werden die einfachen Zucker als Monosaccharide sowie deren Kondensationsprodukte aus zwei bis neun Molekülen als Oligosaccharide und die höhermolekularen als Polysaccharide bezeichnet. Charakteristisch für die Namen der Zucker ist die Endsilbe „-ose“.
Monosaccharide
Nomenklatur von Monosacchariden
Die Monosaccharide enthalten neben einer Carbonylfunktion zwei bis sieben Hydroxylgruppen. Die Klassifizierung beruht auf der Anzahl der Kohlenstoffatome: Triosen (C3H6O3), Tetrosen (C4H8O4), Pentosen (C5H10O5), Hexosen (C6H12O6), Heptosen (C7H14O7) und Octosen (C8H16O8). Weiterhin unterscheidet man je nach Art der Carbonylgruppe; Aldosen haben eine Aldehydfunktion und Ketosen eine Ketogruppe. Die wichtigsten Monosaccharide sind die Pentosen und Hexosen; aber auch Triosen, Tetrosen und Heptosen kommen in der Natur vor; z.B. als Phosphorsäureester im Stoffwechsel.
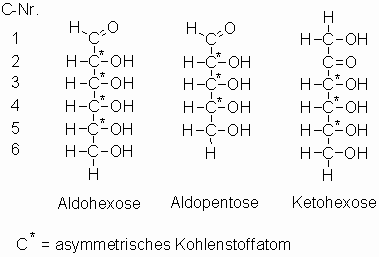
Aldohexosen enthalten 4, Ketohexosen 3 asymmetrisch substituierte Kohlenstoffatome. So sind bis auf Dihydroxyaceton alle Zucker optisch aktiv. Ihre Lösungen drehen die Ebene des polarisierten Lichtes. Die optische Aktivität wird quantitativ als spezifische Drehung [a ]D ausgedrückt:
![]()
Die Temperatur (hier 20°C) und die Wellenlänge des eingestrahlten Lichts (normalerweise die D-Linie des Natriums = 589,3 nm) müssen angegeben werden. An jedem der asymmetrisch substituierten Kohlenstoffatome sind zwei Konfigurationen möglich; diese verhalten sich spiegelbildlich. Somit gibt es für n Asymmetriezentren 2n isomere Verbindungen, z.B. 16 Aldohexosen und 8 Ketohexosen.
Die einfachste, optisch aktive Aldose ist Glycerinaldehyd, CH2(OH)-CH(OH)-CHO. In diesem ist das mittlere Kohlenstoffatom asymmetrisch substituiert. Emil Fischer hat eine einfache, räumliche Darstellungsweise von Monosacchariden entwickelt. Bei der Fischer-Projektionsmethode sind folgende Regeln zu beachten:
- Die Kohlenstoffkette der Verbindung wird in der Senkrechten angeordnet.
- Die Kette wird so orientiert, dass das Ende mit der höheren Oxidationsstufe oben liegt.
- Das Molekül muss so angeordnet werden, dass an jedem asymmetrischen Kohlenstoffatom die Substituenten nach vorn ragen.
- Die Bezeichnung D und L richtet sich nach der Stellung der Hydroxylgruppe am untersten asymmetrischen Kohlenstoffatom.
Beim rechtsdrehenden D-Glycerinaldehyd weist bei Beachtung aller Regeln die Hydroxylgruppe am zweiten Kohlenstoffatom nach rechts (vgl. Abbildung unten). Alle optisch aktiven Verbindungen, die sich unabhängig von ihrer tatsächlichen Drehrichtung von ihm herleiten lassen, betrachtet man als zur D-Reihe gehörig. Beim Glycerinaldehyd stimmen Drehrichtung und Konfiguration zufällig überein (D- oder L-Reihe).
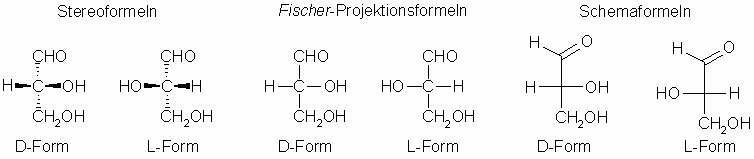
Die obige Abbildung zeigt die optisch aktiven Formen des Glycerinaldehyds, dargestellt in verschiedenen Schreibweisen. Die Projektions- und die Schemaformeln können in der Zeichenebene gedreht, dürfen aber nicht umgeklappt werden.
Schiebt man zwischen die Kohlenstoffatome 1 und 2 des Glycerinaldehyds eine weitere CHOH-Gruppe ein, so entsteht ein neues Asymmetriezentrum. Aus den beiden enantiomeren Trioseformen entstehen je zwei so genannte epimere Tetrosen. Das sind optisch aktive Verbindungen, welche nur an einem Kohlenstoffatom Konfigurationsunterschiede aufweisen, sich aber chemisch und physikalisch unterschiedlich verhalten. Enantiomere unterscheiden sich dagegen nur durch die unterschiedliche Drehrichtung des Lichtes und sie haben als Spiegelbilder die gleichen chemischen Eigenschaften.
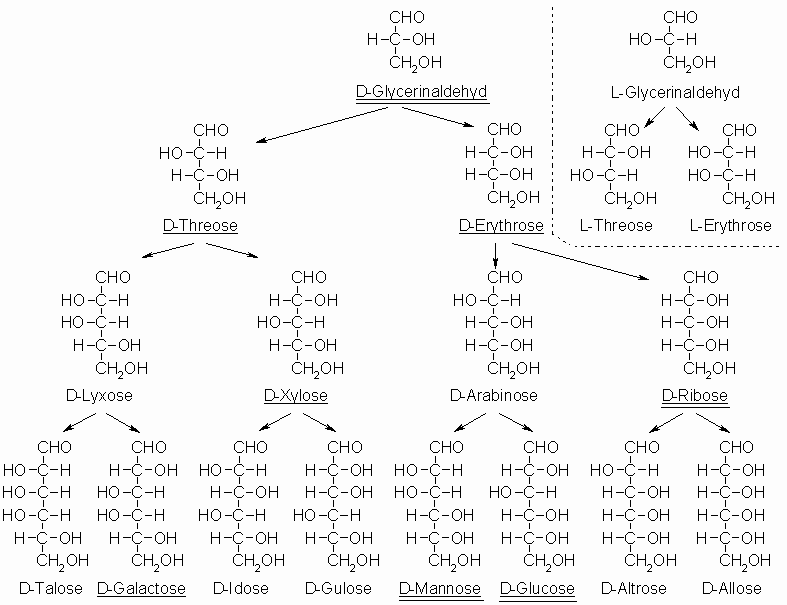
Setzt man den Einbau von CHOH-Gruppen, ausgehend von D-Glycerinaldehyd, fort, so erhält man die Aldosen der D-Reihe. Im obigen Schema sind die Zucker unterstrichen, die im Stoffwechsel vorkommen. Doppelt unterstrichene Zucker sollte man kennen. Die Zugehörigkeit zur D- oder L-Reihe ergibt sich immer aus der Konfiguration am asymmetrischen Kohlenstoffatom mit der höchsten C-Nummer.
Entsprechend erhält man ausgehend von L-Glycerinaldehyd die L-Aldosen. In obigem Schema sind aus Platzgründen nur die beiden L-Tetrosen in der oberen rechten Ecke aufgelistet; die L-Pentosen und L-Hexosen sind nicht angegeben. Formulieren Sie einige Beispiele dafür selbst.
Ausgehend von Dihydroxyaceton erhält man durch Einfügen von CHOH-Gruppen zwischen C-2 und C-3 die Gruppe der Ketosen. Die folgende Abbildung enthält alle Ketosen, also sowohl die der D- als auch die der L-Reihe. Eine wichtige Ketose ist die D-Fructose. Diese hat an den Kohlenstoffatomen 3 bis 5 die gleiche Konfiguration wie das epimere Paar D-Glucose und D-Mannose.
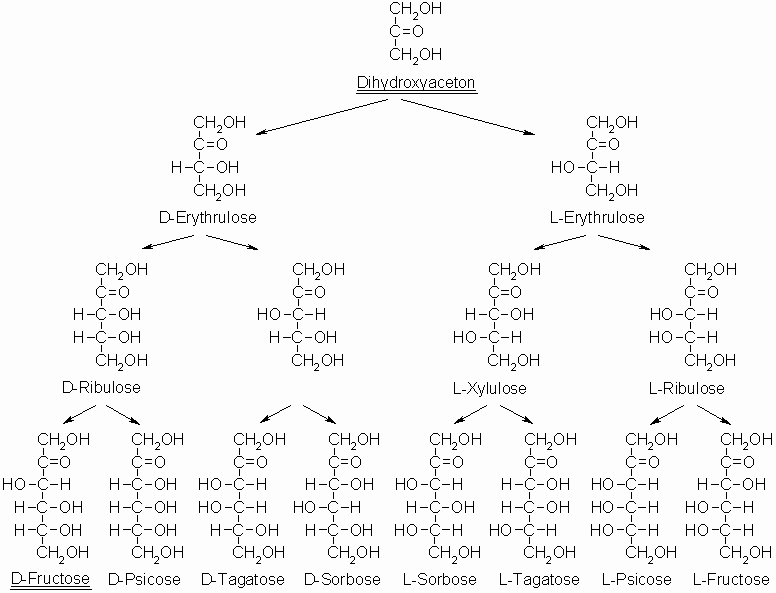
Cyclische, halbacetalische Struktur von Monosacchariden
Zumeist liegen die Carbonylfunktionen der Pentosen und Hexosen nicht in freier Form vor, sondern bilden mit einer der Hydroxylgruppen des gleichen Moleküls ein cyclisches Halbacetal oder -ketal; bevorzugt sind hierbei 5- (Furanosen) und 6-gliedrige (Pyranosen) Ringe. Die Namen leiten sich von Furan bzw. Pyran ab.
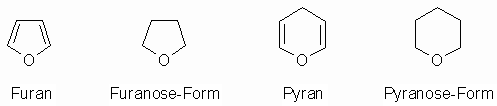
Aus der Carbonylgruppe entsteht dann eine zusätzliche, halbacetalische Hydroxylgruppe, die so genannte glycosidische OH-Gruppe. Die Bildung der Pyranose-Ringform aus einer Aldose durch Reaktion der Hydroxylgruppe am Kohlenstoffatom 5 mit der Aldehydgruppe ist im Folgenden formuliert:
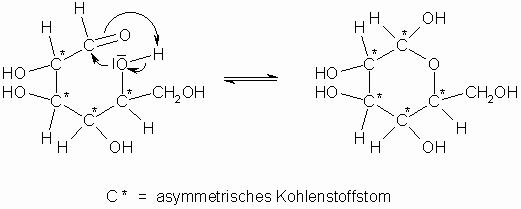
Bei obiger Ringbildung wird auch das Kohlenstoffatom 1 bei Aldosen bzw. 2 bei Ketosen optisch aktiv. Erhöhung der Anzahl der asymmetrischen Kohlenstoffatome im Molekül um 1 bedeutet eine Verdopplung der Anzahl der optisch isomeren Verbindungen, die auch unterschiedlich benannt werden müssen. Man unterscheidet deshalb je nach der Konfiguration an C-Atom 1 zwischen a – bzw. ß-Form. Zwischen diesen stellt sich jedoch in Lösung über die offenkettige Form ein Gleichgewicht ein. Beim Lösen eines Zuckers kann man die Gleichgewichtseinstellung an der Änderung der Drehung der Ebene des polarisierten Lichtes verfolgen. Man beobachtet im Polarimeter zunächst das spezifische Drehvermögen der zu untersuchenden Glucose (a -D-Glucose: 110° bzw. ß-D-Glucose: 23°), das sich aber langsam auf einen Endwert von 53° verändert, der dem Gleichgewichtsgemisch von 38% α -D-Glucose und 62% ß-D-Glucose entspricht. Dieses Phänomen nennt man Mutarotation. Die offenkettige Aldehydform ist nur zu 0,1% am Gleichgewicht beteiligt.
Haworth-Projektion von Monosacchariden und Glycosiden
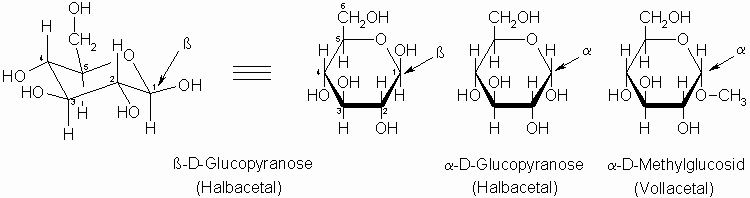
Das obige Schema zeigt die Monosaccharide (hier: Glucose) und ein Glycosid in der so genannten Haworth-Projektion. Hierbei schreibt man die CH2-OH Gruppe bei D-Zuckern oberhalb des Ringes und bei L-Zuckern unterhalb. Steht der Sauerstoff an C-1 (OH, OCH3 oder allgemein OR) trans zur CH2-OH Gruppe, so spricht man von α –ständig, bei cis-Stellung handelt es sich um einen ß-Zucker.
Glycoside
Wie oben schon erwähnt, entstehen Glycoside durch Abspaltung von Wasser aus einem Zucker und einem Molekül Alkohol, Thioalkohol oder Amin.
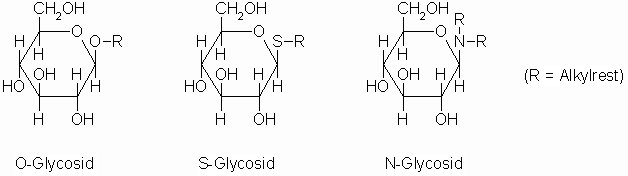
Reaktionen von Monosacchariden
Die Aldehydgruppe der Aldosen lässt sich erwartungsgemäß durch Fehling- oder Tollens-Reagenz oxidieren. Jedoch reagieren auch die Ketosen positiv, da die Ketogruppe im alkalischen Medium über die Endiol-Form mit der entsprechenden Aldose im Gleichgewicht steht.
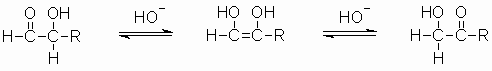
Die Monosaccharide reagieren mit drei Molekülen Phenylhydrazin zu Osazonen, die zur Charakterisierung und Identifizierung der Zucker dienen. Dabei bildet sich zunächst ein Phenylhydrazon bevor die Hydroxylgruppe am C-2 (bei Aldosen) bzw. C-1 (bei Ketosen) zur Carbonylgruppe oxidiert wird. Diese reagiert nun mit einem weiteren Molekül Phenylhydrazin zum Osazon.
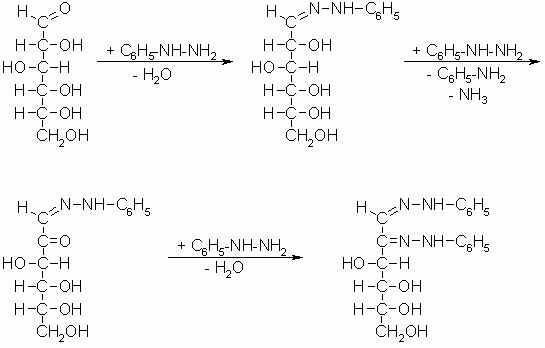
D-Glucose, D-Mannose und D-Fructose ergeben dabei das gleiche Osazon, da bei allen drei Zuckern die Konfiguration ab C-3 identisch ist.
Verwandte Verbindungen der Monosaccharide
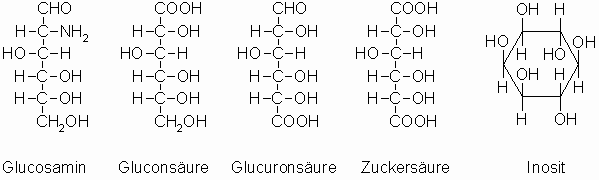
Wichtige, den Monosacchariden verwandte Verbindungen, sind die Aminozucker, wie z.B. Glucosamin sowie Gluconsäure, Glucuronsäure, Zuckersäure und der cyclische Polyakohol Inosit.
Disaccharide
Die Disaccharide bestehen aus zwei Monosaccharid-Molekülen, die unter Abspaltung von Wasser durch eine glycosidische Bindung verknüpft sind.
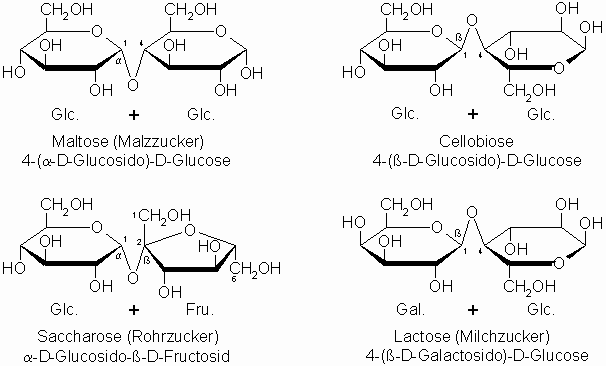
Die Verknüpfung der Monosaccharideinheiten ist entscheidend für das chemische Verhalten der Disaccharide. Nur wenn die funktionelle Gruppe eines Halbacetals vorhanden ist, fallen die Reduktionsproben positiv aus. Die Ringform beeinträchtigt das Reduktionsvermögen nicht, weil sie mit der offenkettigen Form im Gleichgewicht steht (Halbacetal), sofern nicht die anomeren Hydroxylgruppen glycosidisch verbunden sind, wie bei der Saccharose (Vollacetal).
Disaccharide können durch Säuren oder Enzyme gespalten werden. Saccharose wird leicht durch Hefefermente gespalten. Dabei ist das Ausgangsprodukt rechtsdrehend (+67°), Fructose dagegen ist linksdrehend (-91°) und die ebenfalls entstehende Glucose rechtsdrehend (53°). Da jedoch die Linksdrehung der Fructose überwiegt, ist das bei der Rohrzuckerspaltung entstehende äquimolare Gemisch von Fructose und Glucose insgesamt linksdrehend. Diese Erscheinung nennt man Inversion, die herbeiführenden Enzyme Invertasen. Invertzucker liegt beispielsweise im Honig vor. Der von den Bienen gesammelte Nektar enthält neben Rohrzucker in wechselnden Mengen Invertzucker, und im Verdauungstrakt wird der Rohrzucker enzymatisch hydrolysiert, so dass der von den Bienen wieder abgegebene Honig nur noch zu etwa 10% unveränderten Rohrzucker enthält. Der im Kunsthonig enthaltene Invertzucker entsteht durch saure Hydrolyse von Rohrzucker, wobei geringe Säuremengen ausreichen.
Lactose ist der Milchzucker, der zu 4,5% in Kuhmilch vorkommt. In diesem Molekül besitzt der Glucose-Baustein ein Halbacetal; dieses Disaccharid ist deshalb, wie auch Cellubiose und Maltose, reduzierend. Saccharose wird wegen seines Vorkommens auch Rohr- oder Rübenzucker genannt. Dieses Disaccharid ist, wie oben schon erwähnt, nicht reduzierend, d.h. die Fehling- und Tollensreaktion verlaufen negativ. Dies liegt daran, dass das anomere Kohlenstoffatom der Glucose (= Aldose, C-1) mit demjenigen der Fructose (= Ketose, C-2) über Sauerstoff verbunden ist.
Polysaccharide
Bei den Polysacchariden sind vor allem die Stärke und die Cellulose zu nennen. Die Stärke ist eine weit verbreitete Substanz aber chemisch gesehen keine einheitliche Verbindung. Sie setzt sich zu 20 – 30% aus Amylose und zu 70 – 80% aus Amylopektin zusammen. Auch die Größe der Moleküle ist nicht einheitlich. Das Molekulargewicht von Amylose reicht von 10.000 bis 300.000, das des Amylopektins von 50.000 bis 180.000. Entscheidend ist aber die unterschiedliche Struktur. Amylose ist kettenförmig, linear aufgebaut und Amylopektin besitzt Verzweigungen.
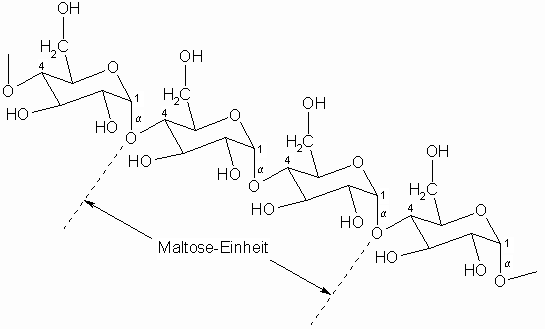
Obige Struktur zeigt einen Ausschnitt aus der Amylose. Bei den Monosaccharid-Bausteinen handelt es sich ausschließlich um Glucose. Diese sind, wie bei Maltose, a -1.4-glycosidisch verbunden. Bedingt durch die a -glycosidische Bindung ist die Kette spiralartig angeordnet was sich mit Hilfe von Iod nachweisen lässt. Das Iod wird in die Spirale eingeschlossen und es bildet sich ein blauer Komplex. Diese Iod-Stärke-Einschlußverbindung zerfällt bei 80°C reversibel in die Komponenten, d.h. die blaue Farbe verschwindet.
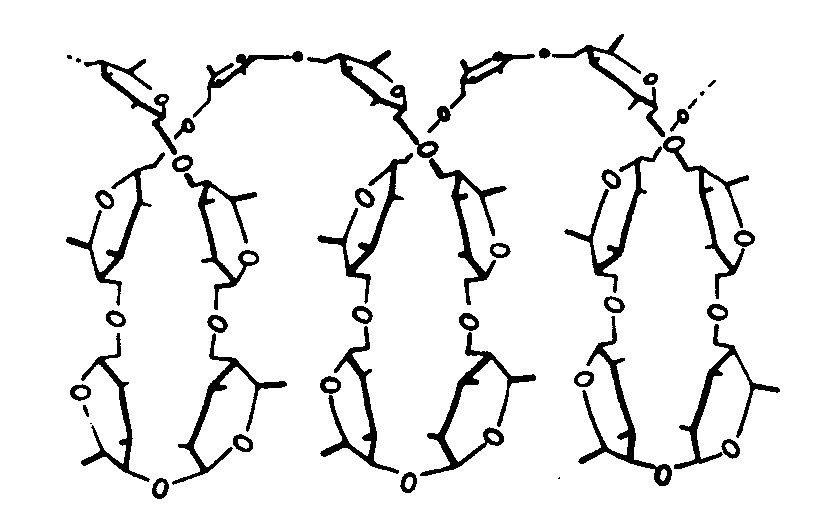
Raumstruktur von Amylose (schematisch)
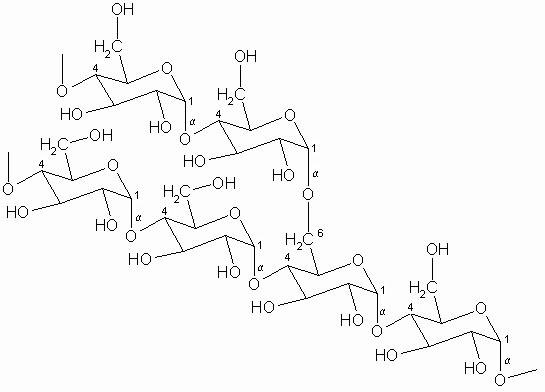
Im Amylopectin werden ähnliche Ketten durch zusätzliche a -1.6-glycosidische Bindungen verzweigt.
Die Stärke wird von den Pflanzen in den Zellen gelagert und im Bedarfsfall enzymatisch zu der leicht im Saftstrom transportierbaren Glucose abgebaut.
Die wasserunlösliche Gerüstsubstanz der Pflanzen, die Cellulose, ist ebenfalls ausschließlich aus Glucose aufgebaut. Die Glucose-Bausteine sind hier allerdings ß-1.4-glycosidisch miteinander verbunden. Während Baumwolle und Flachs aus fast reiner Cellulose bestehen, ist sie im Holz zu etwa 50% enthalten. Die ß-glycosidische Verknüpfung führt zu einer linearen Struktur der Moleküle. Die kettenförmigen Makromoleküle mit einem mittleren Molekulargewicht von etwa 500.000 (ca. 3.000 Glucoseeinheiten) sind parallel zueinander in einer bündelförmigen Sekundärstruktur zusammengelagert. Der Zusammenhalt der einzelnen Ketten erfolgt über zwischenmolekulare Wasserstoffbrücken-Bindungen.
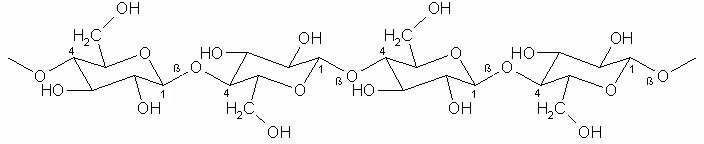
Ausschnitt aus einer Cellulosekette
(Achtung! Jeder zweite Glucose-Baustein ist um 180° gedreht)
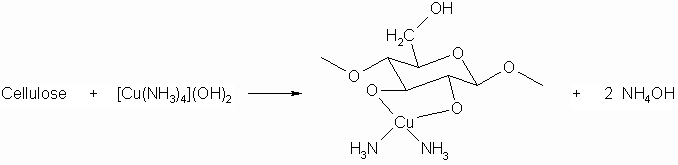
Durch das so genannte Schweizers Reagenz wird Cellulose als Komplex wasserlöslich und kann somit verarbeitet werden. Heißes Wasser zerstört den Komplex und die Cellulose fällt wieder aus.
Der Mensch und die meisten Tiere besitzen kein Enzym, um Cellulose zu spalten; das Polysaccharid dient deshalb nur als – allerdings notwendiger – Ballaststoff. Bei den Wiederkäuern wie den Rindern, Kamelen usw., die Cellulose als Nahrungsmittel verwerten können, erfolgt die Hydrolyse mit Hilfe von Enzymen, die von Darmbakterien geliefert werden. Termiten und Crustaceen schließlich haben selbst die Fähigkeit, Cellulose abzubauen.
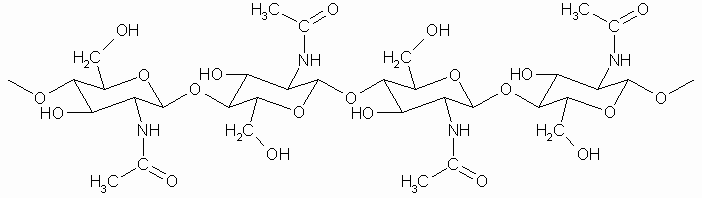
Mit der Cellulose verwandt ist das in Insekten und Crustaceen vorkommende Chitin; es ist aus N-Acetyl-glucosamin aufgebaut:
Weitere interessante Polysaccharide sind im Folgenden kurz mit ihrer Bedeutung und ihren Bausteinen (B) aufgelistet:
- Glycogen: Zuckerreserve der Tiere. B: wie im Amylopektin (also 1.4- und 1.6-verknüpfte Glucose), nur stärker verzweigt.
- Dextran: Wird von einigen Bakterienstämmen produziert. Verwendung als Molekularsieb in der Biochemie (Trennung von Makromolekülen) und als Blutplasmaersatz in der Notfallchirurgie. B: Glucose, 1.4- und 1.6-verknüpft, stark verzweigt.
- Mannan: Zahlreiche Varianten in Nadelhölzern, Steinnuss, Hefe usw. B: Mannose, 1.4-verknüpft.
- Galactan: Im Agar aus roten Meeresalgen, mit Pektin vergesellschaftet. B: Galactose, Struktur analog Cellulose.
- Pektin: Teils pflanzliche Gerüst-Polysaccharide, teils Gelbildner in Fruchtsäften. B: D-Galacturonsäure, Ketten verzweigt.
- Alginsäure: Pektin aus Braunalgen. B: D-Mannuronsäure, ß-glycosidisch und stark verzweigt.
- Inulin: In Dalienknollen, dient zur Bestimmung der Nierenclearance. B: Fructose.
- Chondroitinschwefelsäureester: Im Knorpel, hohe Affinität zu Calcium-Ionen, ß-glycosidisch verknüpft. B: D-Glucuronsäure und N-Acetylgalactosamin.
- Heparin: Hemmt die Blutgerinnung, wird aus Leber gewonnen. B: D-Glucosamin-N-schwefelsäure und Glucuronsäure.
- Hyaluronsäure: In der Eihülle der Säuger, wird bei Befruchtung hydrolysiert. B: N-Acetylglucosamin und Glucuronsäure.