Ursprüngliches: Herzlicher Dank gilt Prof. Dr. H.C. Krebs, der dieses Skript seiner Chemie-Vorlesung zur Verfügung gestellt hat.
Die erweiterte und überarbeitete Version fiel in 2018 einer Attacke auf den Webspace der Biotechberatung zum Opfer. Aufbauend auf dieses für Studierende der Veterinärmedizin geschriebene Skript erfolgen in den kommenden Monaten laufend Änderungen und Erweiterungen, um es für Studierende unterschiedlicher Fachrichtungen mit dem Nebenfach attraktiv zu halten. Synthesen, wie sie oft in biologischen Labors eingesetzt werden, um beispielsweise Proteine zu markieren oder Moleküle zu derivatisieren, fehlen derzeit noch.
Geschichtliches
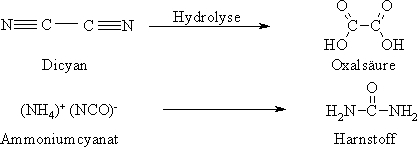
Die Chemie ist eine relativ junge Wissenschaft insofern, als die Systematisierung ihrer Ergebnisse und die darauf beruhende Aufstellung von Theorien wesentlich später erfolgten als beispielsweise auf den Gebieten der Mathematik oder Physik. Sie ist die Lehre von der Natur der Stoffe und deren Umsetzungen. Nach der Begriffsprägung des Mittelalters wurde die Chemie nach dem Vorkommen der Stoffe in der Natur in Mineralchemie (Anorganische Chemie) und in Tier- und Pflanzenchemie (Organische Chemie) eingeteilt. Die Besonderheit der organischen Chemie sah man in dem Wirken einer Lebenskraft (vis vitalis). Man war der Ansicht, dass Substanzen aus dem Bereich der organischen Chemie nur von lebenden Organismen synthetisiert und nicht künstlich hergestellt werden könnten. Als 1824 Friedrich Wöhler aus anorganischen Ausgangsstoffen die im Sauerklee vorkommende Oxalsäure und wenig später, 1828, aus einem anorganischen Salz, dem Ammoniumcyanat, den im tierischen Organismus als Stoffwechselprodukt gebildeten Harnstoff darstellte, war es an der Zeit, die Lebenskraft aus dem Gedankengut der organischen Chemie zu streichen.
Die Einteilung in Organische und Anorganische Chemie wurde beibehalten. Man definierte allerdings die Organische Chemie als die Chemie der Kohlenstoffverbindungen. Diese Sonderstellung des Kohlenstoff war insofern sinnvoll, als sich dieses Element von den übrigen durch einige typische Eigenarten unterscheidet, von denen vor allem die Fähigkeit der Kohlenstoffatome, zu ketten- und ringförmigen Verbindungen zusammenzutreten, zu nennen ist. Daraus resultiert, dass heute mehrere Millionen organische Substanzen bekannt sind, ein etwa hundertfaches der bekannten anorganischen Verbindungen. Diese Mannigfaltigkeit der Kohlenstoffverbindungen wird bedingt durch die Stellung dieses Elementes in der Mitte der zweiten Periode des Periodensystems. Der Kohlenstoff besitzt nur geringe Tendenz zur Bildung von Ionen, jedoch ein maximales Bestreben zur festen Verknüpfung durch Atombindungen.
Chemische Bindungen in organischen Molekülen
Während in anorganischen Verbindungen häufig ionische (= heteropolare) Bindungen (Salze, z.B. Na+ Cl–) vorkommen, sind diese in organischen Molekülen nur selten. Hier findet man überwiegend kovalente (= homöopolare) Bindungen, die unpolar (z.B. C-H, C-C) oder auch polar (z.B. C-O, C-Cl) sein können. Die Polarisierung der Bindung ergibt sich aus der unterschiedlichen Elektronegativität der Bindungspartner. Man symbolisiert dies durch Partialladungen (d+, d–), z.B. bei einer C-Cl-Bindung:
![]()
So vermag der Kohlenstoff mit zahlreichen rechts und links von ihm im Periodensystem stehenden Elementen stabile Atombindungen zu bilden. Neben dem Kohlenstoff und dem Wasserstoff kommen häufig noch Sauerstoff, Stickstoff, Schwefel, Phosphor, Halogene und gelegentlich auch andere Elemente wie z.B. Metalle in organischen Verbindungen vor. Einige, so genannte funktionelle Gruppen, die für gewisse Verbindungsklassen charakteristisch sind, sind im Anhang aufgelistet. Eine kovalente Bindung ergibt sich durch Überlappung von Orbitalen zweier Elemente. In der organischen Chemie sind vor allem die s- und p-Orbitale wichtig. Wie aus der folgenden Abbildung ersichtlich ist, besitzt ein s-Orbital die Form einer Kugel, während die p-Orbitale handelförmig sind. Bei letzterem sind die beiden Orbitallappen durch eine Knotenfläche voneinander getrennt, in der die Wahrscheinlichkeit, ein Elektron anzutreffen, gleich Null ist. Während es pro Hauptquantenzahl nur ein s-Orbital gibt, sind es ab der zweiten Periode drei p-Orbitale mit jeweils gleichem Energieinhalt, die längs der x-, y- und z-Achse eines rechtwinkeligen Koordinatensystems orientiert sind. Beim Kohlenstoffatom sind im Grundzustand die Valenzorbitale wie folgt besetzt: 2s2, 2p2 (in zwei p-Orbitalen je 1 Elektron, das dritte p-Orbital ist nicht besetzt). Im Methan bindet ein Kohlenstoffatom gleichartig vier Wasserstoffatome, die ihn tetraedrisch umgeben. Dies ist mit dem oben erwähnten Grundzustand nicht erklärbar. Aus dem 2s- und den drei 2p-Orbitalen bildet der Kohlenstoff vier sp3-Hybrid-Orbitale, die energetisch gleich und mit jeweils einem Elektron besetzt sind. Durch Überlappung mit einem Orbital eines zweiten Atoms, das ebenfalls mit einem Elektron besetzt ist, kommt es zu einer Bindung. Der Kohlenstoff kann auch drei sp2-Hybrid-Orbitale (aus dem 2s- und zwei 2p-Orbitalen) oder zwei sp-Hybrid-Orbitale (aus dem 2s- und einem 2p-Orbital) bilden. Ein bzw. zwei p-Orbitale bleiben dann als solche erhalten. Diese Hybridisierung soll aber erst bei den entsprechenden Verbindungsklassen (Alkene und Alkine) besprochen werden.
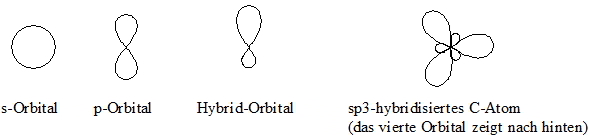
Zugegeben, Orbitale sind nicht eben anschaulich. Wenn ein Atom vier Substituenten (Bindungspartner) und nachweislich vier gleichartige Bindungen zu diesen Partnern hat, dann werden diese Bindungspartner einander möglichst viel Raum geben. Die Abstoßung zwischen den bindenden Elektronenpartnern sorgt ebenfalls für einen möglichst großen Abstand (Elektronenpaarabstoßungsmodell). Aus diesen Überlegungen ergibt sich für ein Atom mit vier gleichartigen Bindungen ein Tetraeder in dessen Mitte sich in unserem Fall der Kohlenstoff und an dessen Spitzen sich die Bindungspartner befinden.
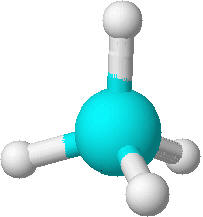
Das Kugel-Stab-Modell soll die Beziehung zwischen den Atomen veranschaulichen. Es ist das Modell des Methans (CH4). Die türkisfarbige Kugel repräsentiert den Kohlenstoff während die weißen Kugeln die Wasserstoffatome darstellen. Methan ist also ein dreidimensionales Molekül.