Der „Standardvertreter“ der aromatischen Verbindungen ist das Benzol. Die Bezeichnung „aromatische Verbindungen“ geht auf einige aus Pflanzen isolierte Abkömmlinge des Benzols mit angenehmem, aromatischen Geruch zurück. Aus der Summenformel des Benzols (C6H6) geht hervor, daß es sich um eine stark ungesättigte Verbindung handelt. Dennoch unterscheidet es sich von den Alkenen. Im Gegensatz zu diesen zeigt das Benzol eine sehr geringe Bereitschaft zu Additionsreaktionen und geht bevorzugt Substitutionsreaktionen ein. Kekulé schlug 1865 für das Benzol die folgende Struktur vor:
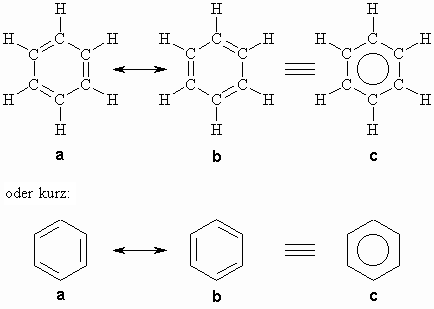
Dass die beiden Formeln a und b identisch sind, erkennt man dadurch, dass die folgenden Strukturen keine isomeren Verbindungen sondern das selbe Molekül darstellen.
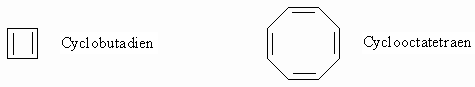
Das Benzol ist also nicht als Cyclohexatrien aufzufassen, sondern als ein planarer, gleichseitiger Sechsring mit einer geschlossenen p -Elektronenwechselwirkung. Die Orbitale der p -Elektronen stehen senkrecht auf der Ringebene. Alle sechs Kohlenstoffatome sind gleichwertig und haben den gleichen Bindungsabstand (1,39 Å), der zwischen dem einer C=C-Doppelbindung (1,34 Å) und einer C-C-Einfachbindung (1,54 Å) liegt, zu den beiden nächsten Kohlenstoffnachbarn. Die Wechselwirkung der p -Elektronen bewirkt eine Senkung des Energieniveaus des Benzols gegenüber dem des hypothetischen Cyclohexatriens. Der Energieunterschied kann aus der Hydrierwärme des Benzols bestimmt werden. Die Hydrierwärme des Cyclohexens zum Cyclohexan beträgt D H=-119,7 kJ/Mol. Danach sollte die Hydrierwärme des hypothetischen Cyclohexatriens zum Cyclohexan D H= 3 x (-119,7 kJ/Mol) = -359,1 kJ/Mol betragen. Die Hydrierwärme des Benzols wurde aber zu -208,4 kJ/Mol bestimmt. Danach kommt dem Benzol eine Stabilisierungsenergie von 150,7 kJ/Mol zu. Der größte Teil davon wird durch die Delokalisierung der p -Elektronen bewirkt. Man nennt dies Resonanz- oder Mesomerieenergie. Diese Tatsache wird durch obige Struktur c symbolisiert. Nach quantenchemischen Berechnungen von E. Hückel sollen sich allgemein monocyclische, planare Systeme mit (4n + 2) p -Elektronen (n = 0, 1, 2, 3, usw.) gleichfalls durch eine ausgeprägte p -Elektronendelokalisierung auszeichnen und im Grundzustand eine dem Benzol ähnliche thermodynamische Stabilität besitzen („aromatischer Charakter“). Im Einklang mit der Hückel-Regel besitzen Cyclobutadien und Cyclooctatetraen keinen „aromatischen Charakter“. Sie haben vier bzw. acht p -Elektronen und das ist keine Lösung der Gleichung (4n + 2) mit n gleich Null oder einer positive, ganze Zahl.
Nomenklatur der Aromaten
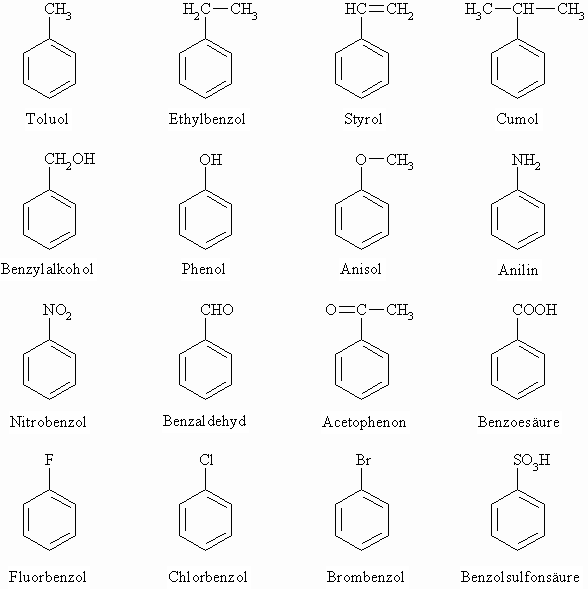
Die Nomenklatur der aromatischen Verbindungen ist leider wenig systematisch; viele Substanzen besitzen Trivialnamen.
Man verwendet für die Stellung zweier Substituenten die Buchstaben o- (ortho). m- (meta) oder p- (para). Ausnehme: zwei Hydroxygruppen.
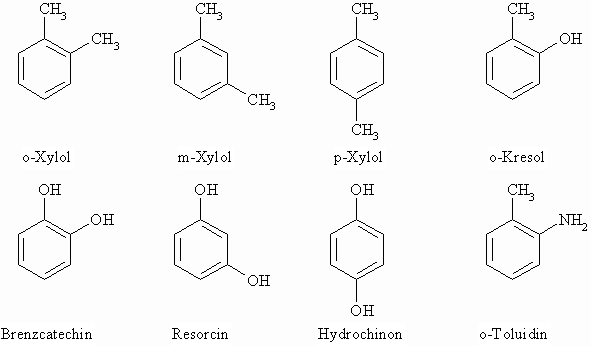
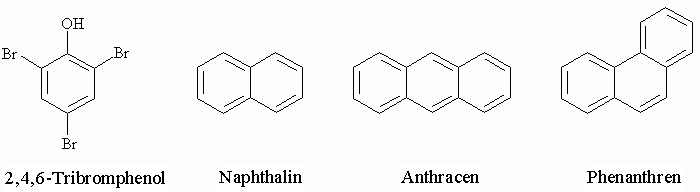
Bei mehr als zwei Substituenten werden die Kohlenstoffatome numeriert. Die folgende Abbildung zeigt auch drei bi- bzw. tricyclische Aromaten.
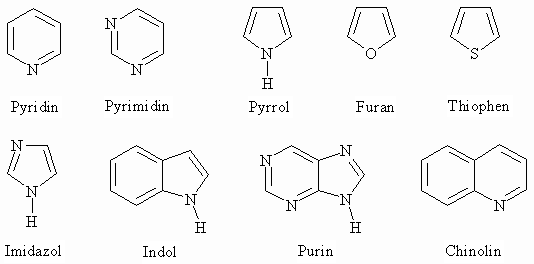
Weiterhin gibt es heterocyclische Aromaten, also Ringe die nicht nur Kohlenstoff sondern auch Sauerstoff, Stickstoff oder Schwefel enthalten.
Abschließend seien noch folgende zwei Reste benannt:

Elektrophile aromatische Substitution
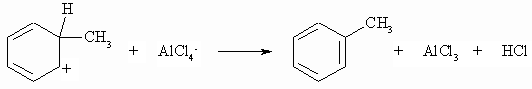
Mechanistisch steht die elektrophile aromatische Substitution mit der Addition elektrophiler Agentien an Alkene (s. Kapitel „Alkene“) in naher Beziehung. In beiden Fällen reagieren Elektrophile mit p -Elektronensystemen nach einem polaren Mechanismus. Wie im Falle der Addition an C=C-Doppelbindungen bildet sich auch bei der elektrophilen aromatischen Substitution nach einem p -Komplex ein Kation (s -Komplex), das hier aber durch Mesomerie stabilisiert ist. Es handelt sich aber hierbei nicht mehr um ein aromatisches System. Der s -Komplex spaltet nun leicht unter Rückbildung einer aromatischen Verbindung ein Proton ab. Der allgemeine Mechanismus ist wie folgt:
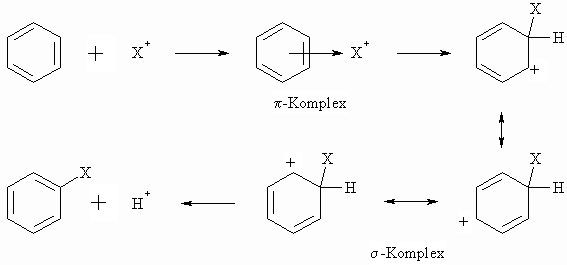
Zu den wichtigsten Reaktionen des Benzols (und seiner Derivate) nach diesem Mechanismus gehören die Halgenierung, Nitrierung, Sulfonierung, Alkylierung und Acylierung.
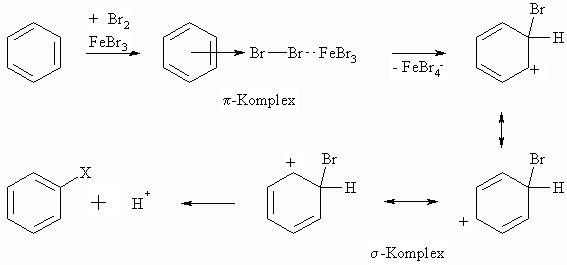
Das Brom ist nicht reaktiv genug, um mit Benzol zu reagieren. Eine Reaktion erfolgt erst unter dem Einfluß von Katalysatoren. Hierfür werden Lewis-Säuren wie z.B. FeBr3 und AlCl3 verwendet. Demgegenüber ist Fluor viel zu reaktiv, als dass mit Benzol ein definiertes Produkt entsteht.
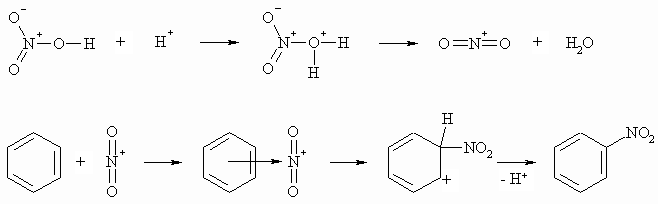
Die Nitrierung von Benzol erfolgt zumeist mit sogenannter „Nitriersäure“, das ist ein Gemisch aus Salpetersäure und Schwefelsäure. Dabei wird zuerst das Nitronium-Ion (NO2+) als elektrophiles Agens gebildet.
Benzol wird durch Schwefeltrioxid (aus konz. Schwefelsäure) sulfoniert wobei Benzolsulfonsäure entsteht. Das elektrophile Agens ist das SO3, wobei der Schwefel durch den Elektronenzug der drei Sauerstoffatome und Protonierung positiviert ist.
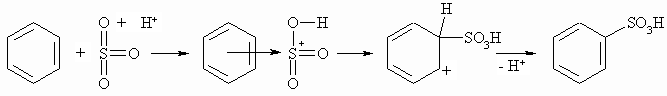
Benzol reagiert nach Friedel und Crafts mit Alkylhalogeniden in Gegenwart von Lewis-Säuren (z.B. AlCl3) zu Alkylbenzol.
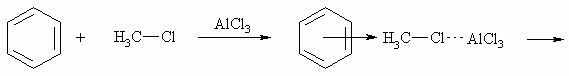
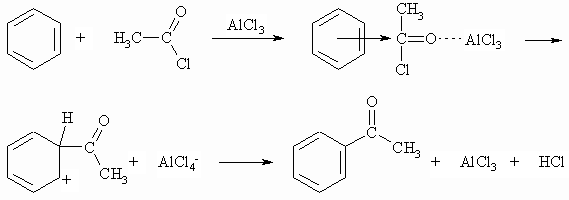
Die Acylierung von Benzol nach Friedel und Crafts mit Carbonsäurehalogeniden führt zu Arylketonen. Auch diese Reaktion muss mit einer Lewis-Säure katalysiert werden.
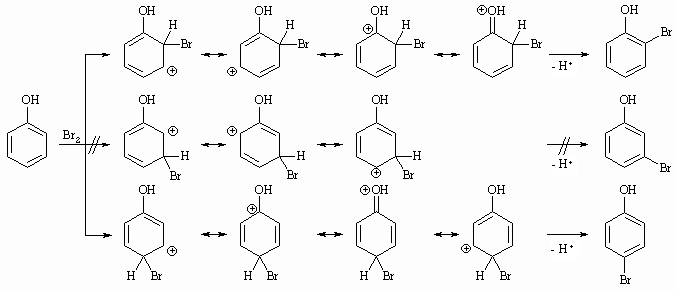
Die bis jetzt formulierten elektrophilen aromatischen Substitutionsreaktionen erfolgten immer am Benzol. Wir wollen nun klären, welchen Einfluß ein schon vorhandener Substituent auf diese Reaktion ausübt. Zum einen kann der vorhandene Substituent die Elektronendichte im Aromaten erhöhen oder erniedrigen und damit diesen reaktiver bzw. weniger reaktiv machen. Des weiteren hat der vorhandene Substituent einen Einfluß auf die Position der Zweitsubstitution und entscheidet damit, welches Isomer (ortho, meta, para) entsteht. Substituenten 1.Ordnung (Alkyl-, HO-, RO-, H2N-Gruppen) aktivieren den Aromaten für die elektrophile Substitution, d.h. die Reaktionsgeschwindigkeit ist größer als bei der Substitution am Benzol. Gleichzeitig dirigieren diese Substituenten in die ortho- oder para-Position während das meta-Produkt nicht entsteht. Halogensubstituenten desaktivieren den Aromaten, doch lenken sie den neu eintretenden Substituenten gleichfalls in die ortho- und para-Stellung. Substituenten 2.Ordnung (-NO2, -COOR, – CHO, -CO-R, -CN, -NR3+, -SO2-OR) desaktivieren den Aromaten, d.h. die Reaktionsgeschwindigkeit ist kleiner als die des Benzols. Zugleich dirigieren diese Substituenten den neu eintretenden Substituenten in die meta-Position.
Substituenten 1.Ordnung sind Elektronendonatoren und erhöhen die Elektronendichte im Aromaten. Läßt man die Alkylgruppen unberücksichtigt, ist in allen Fällen der Benzolring mit einem Atom verbunden, das ein freies Elektronenpaar besitzt. Dieses kann durch Mesomerie dem Aromaten zur Verfügung gestellt werden. Bei Substituenten 2.Ordnung geht von dem mit dem Ring direkt verbundenen Atom des Substituenten im allgemeinen eine Doppelbindung zu einem elektronegativeren Element aus, das durch Mesomerie Elektronen aufnehmen kann, oder die Gruppe wirkt als Ganzes durch einen starken induktiven Effekt Elektronen anziehend wie z.B. –CF3 oder –NH3+. Bis auf bei den Halogenen überwiegt immer der mesomere Effekt den induktiven Effekt. So hat zwar die Hydroxygruppe durch die stärkere Elektronegativität des Sauerstoffs gegenüber Kohlenstoff induktiv einen Elektronen anziehenden Effekt (-I-Effekt) aber der mesomere Effekt (+M-Effekt), wie im Folgenden Schema gezeigt, überwiegt. Die Halogene haben einen sehr starken –I-Effekt und einen +M-Effekt.
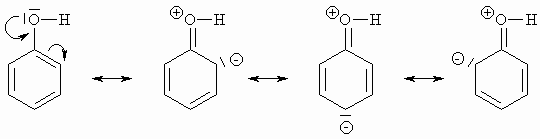
Substituenten 2.Ordnung haben einen –I- und einen –M-Effekt. Die funktionelle Gruppe nimmt Elektronen auf, so daß es zur Ausbildung einer positiven Ladung im Benzolring kommt. Diese sei im Folgenden am Beispiel einer Carbonyl- bzw. Carboxylgruppe gezeigt:
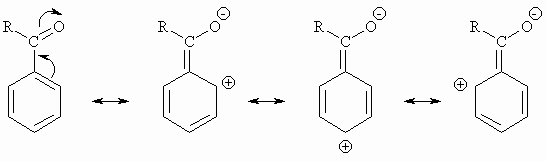
Der dirigierende Einfluß des ersten, schon vorhandenen Substituenten auf die Angriffsstelle des zweiten ist durch den Energieinhalt des zwischenzeitlich entstehenden s -Komplexes zu erklären. Je weiter die positive Ladung im s -Komplex delokalisiert ist, d.h. je mehr mesomere Grenzstrukturen es gibt, um so günstiger ist er.
a) Dirigierende Wirkung eines Substituenten 1.Ordnung:
b) Dirigierende Wirkung eines Substituenten 2.Ordnung:
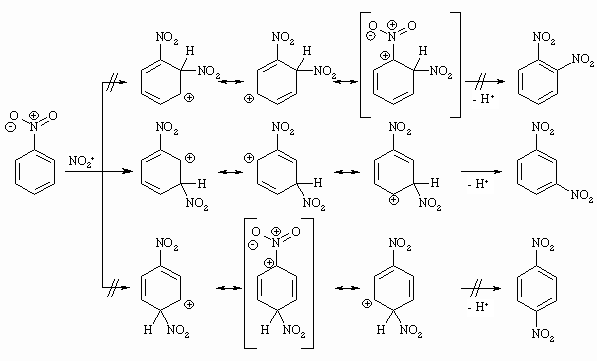
In obigem Schema sind die in Klammer stehenden mesomeren Grenzstrukturen sehr ungünstig, da hier zwei positive Ladungen (an C und an N) direkt benachbart sind.
Acidität von Phenolen
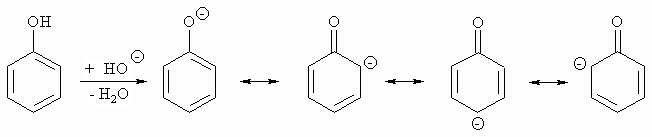
Die phenolische OH-Gruppe ist merklich acide, da das entstehende Anion (= Phenolat) durch Mesomerie stabilisiert ist (pKs = 10).
Aromatische Diazoniumsalze und ihre Reaktionen
Primäre aromatische Amine reagieren mit salpetriger Säure wie primäre aliphatische Amine, nur ist hier das entstehende Diazoniumsalz isolierbar, wenn auch nur in Lösung und unter Kühlung auf etwa 0°C (zum Mechanismus vgl. Kapitel 11.4). Durch Mesomerie mit dem aromatischen Rest ist hier das Diazoniumsalz unter den genannten Bedingungen beständig.
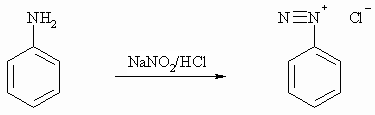
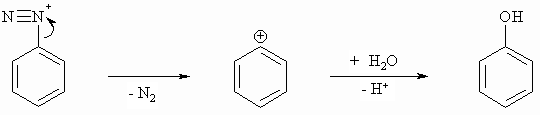
Die aromatischen Diazoniumsalze reagieren mit zahlreichen Partnern sowohl unter Verlust als auch unter Erhalt der Diazo-Funktion. Beim Erwärmen spalten sie molekularen Stickstoff ab und das entstehende Kation reagiert mit Wasser zu Phenol. Diese Reaktion wird als Phenolverkochung bezeichnet.
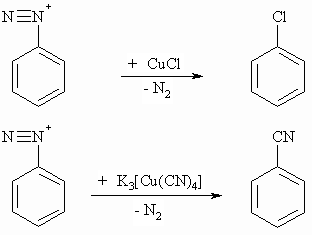
Bei der Sandmeyer-Reaktion werden die aromatischen Diazoniumsalze zu chlorierten Aromaten bzw. aromatischen Nitrilen umgesetzt.
Fluor läßt sich nach der Schiemann-Reaktion in Aromaten einführen.
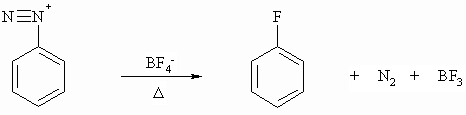
Alle obigen Reaktionen, d.h. Phenolverkochung, Sandmeyer- und Schiemann-Reaktion, stellen eine nucleophile aromatische Substitution dar. Es wird immer die N2-Gruppe als Stickstoff abgespalten und gegen ein Nucleophil ausgetauscht.
In der folgenden Reaktion wird die Diazofunktion erhalten. Das Diazoniumsalz greift als Elektrophil einer anderen, reaktiven Aromaten an. Es kommt hierbei zu einer elektrophilen aromatischen Substitution wobei Azofarbstoffe entstehen.
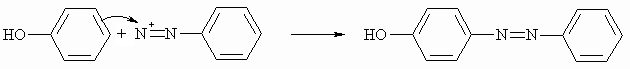
Benzol selbst ist nicht reaktiv genug für diese Reaktion; man verwendet deshalb Phenole oder andere Aromaten mit Substituenten, die die Elektronendichte im Benzolring erhöhen.
Nucleophile aromatische Substitution
Im vorigen Kapitel haben wir schon nucleophile aromatische Substitutionen (z.B. Phenolverkochung) kennengelernt. Hierbei ist zuerst der Substituent (Stickstoff) abgespalten worden, bevor das Nucleophil angreifen konnte.
In aromatischen Halogeniden läßt sich das Halogen nur schwer nucleophil austauschen, da ein freies Elektronenpaar des Halogens in die Mesomerie des Aromaten einbezogen ist (+ M-Effekt). Die nucleophile Substitution des Halogens in aromatischen Halogeniden wird aber durch Elektronen ziehende Gruppen wie z.B. Nitro-Reste in ortho- oder para-Stellung zum Halogen erleichtert.
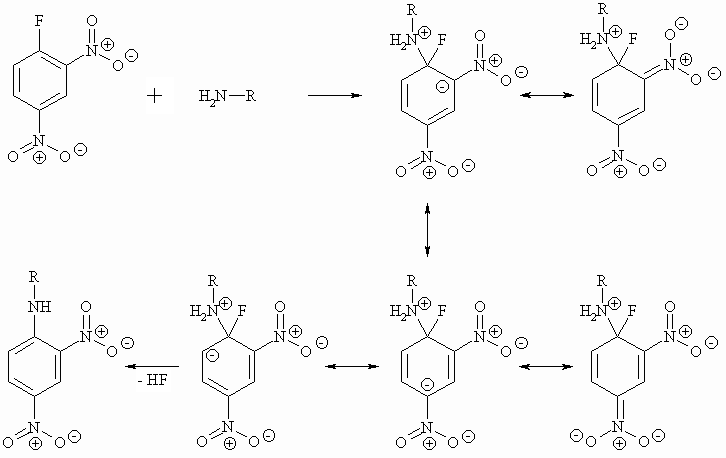
Der Stickstoff greift mit seinem freien Elektronenpaar am stark positivierten Kohlenstoff der C-F-Gruppe an. Da, wie man weiß, das Fluor nicht gleichzeitig mit dem Angriff abgespalten wird, muß im aromatischen Rest die negative Ladung zwischenzeitlich stabilisiert werden. Wie man oben sieht, können die beiden Nitrogruppen die Elektronen (und damit die negative Ladung) durch Mesomerie aufnehmen. Sie tragen somit zur Stabilisierung der Zwischenstufe bei.
Diese nucleophile aromatische Substitution ähnelt der SN2-Reaktion am gesättigten Kohlenstoffatom. Im Gegensatz zu dieser verläuft sie jedoch über eine Zwischenstufe; bei der SN2-Reaktion gibt es dagegen nur einen Übergangszustand (s. Kapitel „Reaktionsmechanismen“).
Oxidationsreaktionen bei aromatischen Verbindungen
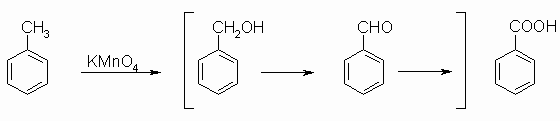
CH-, CH2– und CH3-Gruppen neben einem Benzolrest sind gegen Oxidation empfindlich. So läßt sich z.B. Toluol mit Kaliumpermanganat über Benzylalkohol und Benzaldehyd zu Benzoesäure oxidieren.
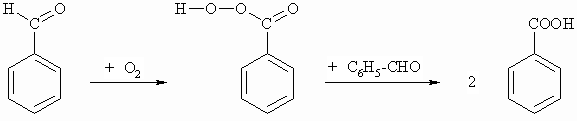
Benzaldehyd wird schon durch Luftsauerstoff in einer radikalischen Reaktion oxidiert. Die zwischenzeitlich entstehende Perbenzoesäure oxidiert ein weiteres Molekül Benzaldehyd und wird selbst zur Benzoesäure reduziert (Synproportionierung).
Hydrochinon kann schon unter milden Bedingungen zum Chinon oxidiert werden. Hydrochinon und Chinon bilden das folgende Redoxsystem:
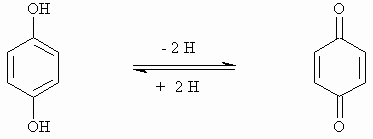
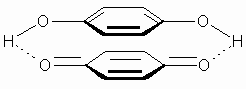
Beide Substanzen bilden im Molverhältnis 1:1 einen kristallinen, dunkelgrünen Komplex, das Chinhydron mit folgender Struktur:
Das chinoide System ist ein wichtiger Chromophor verschiedener organischer Farbstoffe. Im Tier- und Pflanzenreich sind die Chinone weit verbreitet und erfüllen verschiedene Funktionen. Zu den Chinonen zählt u.a. das Vitamin K1 und das Ubichinon. Letzteres hat eine wichtige Funktion in der Atmungskette.
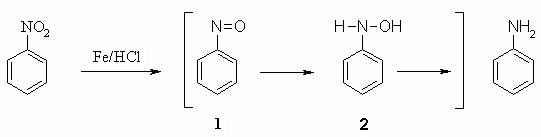
Reduktion von Nitrobenzol
Nitrobenzol, das durch Nitrierung von Benzol leicht zu erhalten ist (s. Kapitel 21.2), kann mit Eisen und Salzsäure zu Anilin reduziert werden. Die Reaktion verläuft stufenweise über Nitrosobenzol (1) und Benzolhydroxylamin (2).