Nomenklatur der Alkane
Die homologe Reihe der gesättigten Kohlenwasserstoffe (Alkane) baut sich nach der allgemeinen Summenformel CnH2n+2 auf. Charakteristisch am Namen ist die Endsilbe –an. Die ersten vier Vertreter besitzen Trivialnamen (n=1 CH4: Methan, n=2 CH3-CH3: Ethan, n=3 CH3-CH2-CH3: Propan, n=4 CH3-CH2-CH2-CH3: Butan). Danach werden sie nach einer systematischen Nomenklatur unter Verwendung griechischer Zahlnamen benannt (n=5: Pentan, n=6: Hexan, n=7: Heptan, n=8: Octan, n=9: Nonan, n=10: Decan, usw.). Ab dem Butan gibt es Isomere, d. h. Verbindungen mit gleicher Summenformel aber unterschiedlicher Struktur. Dabei nimmt die Anzahl der Isomeren rasch zu; es gibt zwei Butan-, drei Pentan-, fünf Hexan-, neun Heptan-, 18 Octan-, 35 Nonan-, 75 Decan-Isomere und bei Icosan (C20H42) sind es schon 366.319. Dies liegt daran, dass nicht nur kettenförmige Alkane, sogenannte n-Alkane, vorkommen sondern auch Verzweigungen auftreten. Dies und die unterschiedliche Benennung der Isomeren seien am Beispiel der Hexane erklärt.
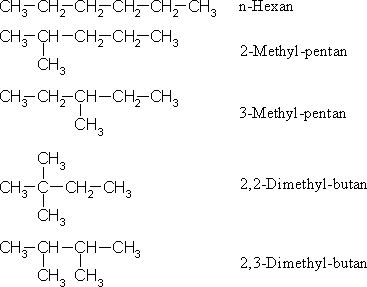
Nach der sogenannten IUPAC-Nomenklatur (International Union for Pure and Applied Chemistry) wird die längste Kohlenstoffkette im Molekül gesucht, was den Grundnamen ergibt. Substituenten (CH3– = Methyl-, CH3-CH2– = Ethyl-, CH3-CH2-CH2– = n-Propyl-, (CH3)2CH- = Isopropyl-, usw.) werden in alphabetischer Reihenfolge dem Namen vorangestellt, wobei zu berücksichtigen ist, dass die Positionen der Substituenten immer die niedrigsten Zahlen ergeben. So ist der Name 2-Methylpentan richtig, 4-Methylpentan aber falsch, obwohl die beiden folgenden Zeichnungen identisch Moleküle darstellen.

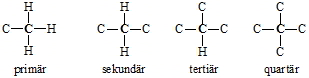
Nach der Zahl der Kohlenstoffsubstituenten unterscheidet man primäre, sekundäre, tertiäre und quartäre Kohlenstoffatome:
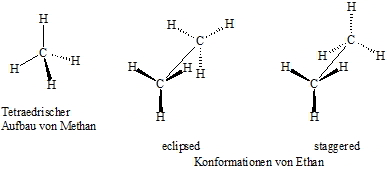
Wie in Kapitel 1.2. schon erwähnt, sind alle Kohlenstoffatome in den Alkanen sp3 hybridisiert und somit tetraedrisch von seinen vier Bindungspartnern umgeben. Der Winkel zwischen zwei Bindungen liegt bei etwa 109°. Die C-H- und C-C-Bindungen sind frei drehbar. Dies bedingt unterschiedliche Konformationen, von denen u. a. zwei extreme Anordnungen möglich sind, wie in der folgenden Abbildung am Beispiel des Ethans zu sehen ist. Die „staggered“ Form ist gegenüber der „eclipsed“ Form energetisch begünstigt, da die Wasserstoffatome auf Lücke stehen und somit weiter voneinander entfernt sind. Die Potentialschwelle zwischen den beiden Konformeren beträgt ca. 10,5 kJ/mol. Die Konformeren lassen sich nicht voneinander trennen. Keilförmig gezeichnete Bindungen gehen räumlich nach vorne aus der Zeichenebene, gestrichelte Bindungen stehen nach hinten.
Vorkommen von Alkanen
Die wichtigsten Quellen für Alkane sind das Erdgas und das Erdöl. Letzteres ist ein sehr komplexes Gemisch und hat je nach Herkunft verschiedene Zusammensetzung. Durch eine fraktionierte Destillation wird es aufgetrennt in Rohbenzin (bis 180°C), Petroleum (180 – 250°C), Heiz-/Dieselöl (250 – 320°C) und Parafinöl (über 320°C). Das Rohbenzin enthält Kohlenwasserstoffe mit einer Kohlenstoffzahl von fünf bis zehn und wird nochmals destilliert, wobei Petrolether (bis 70°C), Leichtbenzin (70 – 100°C), Ligroin (100 – 130°C) und Kerosin (130 – 180°C) erhalten werden. Das Erdgas besteht aus Methan, Ethan, Propan und den beiden Isomeren des Butans.
Unter „Klopfen“ des Motors versteht man die vorzeitige Entzündung eines Benzin-Luft-Gemisches bei der Kompression. Als Maß für die Güte eines Benzins wurde im Jahre 1927 die Octanzahl eingeführt, indem man willkürlich dem n-Heptan, das ganz besonders zum Klopfen neigt, die Octanzahl 0 und dem Isooctan (= 2,2,4-Trimethyl-pentan), das sich erst bei höherer Kompression entzündet, die Zahl 100 zuteilte. Die Octanzahl eines Benzins entspricht dem Isooctangehalt der Vergleichsmischung aus Isooctan und n-Heptan mit der gleichen Klopffestigkeit.
Der heutige Benzinbedarf übersteigt die bei der Destillation des Erdöls anfallende Menge. Es wurden deshalb weitere Verfahren zur Benzingewinnung, wie z.B. das „Cracken“, entwickelt. Hierbei werden höhermolekulare Kohlenwasserstoffe thermisch und katalytisch in niedere Moleküle gespalten.
Die Methanogenese, die durch anaerobe Archebakterien bewirkt wird, ist der letzte Schritt des natürlichen Abbaus von Biomasse. Diese Bakterien kommen auch in Warmblütern, z.B. im Pansen von Wiederkäuern vor. Ein Rind gibt täglich bis zu 900 l Gas ab, die 27% Methan enthalten.
Eigenschaften von Alkanen
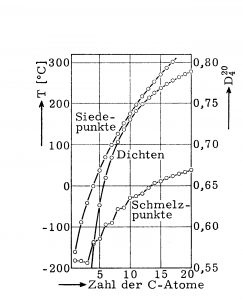
Alkane sind unpolare, mit Wasser nicht mischbare und leicht flüchtige Substanzen. C1– bis C4-Verbindugen sind gasförmig. Weiter bis etwa C16 sind sie flüssig und darüber wachsartig fest. Genauso wie die Siedepunkte steigen die Schmelzpunkte und die Dichten mit wachsender Zahl an Kohlenstoffen. Die stetige Zunahme der Siedepunkte wird durch die Molekülattraktion durch van der Waals-Kräfte bedingt, die eine Oberflächenfunktion sind und daher mit zunehmender Molekülgröße anwachsen. Besonders gut ist dies bei den n-Alkanen (siehe Abbildung 1) zu beobachten. Verzweigte Alkane sieden niedriger als ihre geradkettigen Isomere, da durch ihre mehr kugelige Form die zwischenmolekularen Kräfte geringer sind.
Abbildung 1: Schmelzpunkt, Siedepunkt und Dichte ([D] bei 20°C bezogen auf Wasser von 4°C) der n-Alkane bei 101,32 kPa in Abhängigkeit von der Zahl der Kohlenstoffatome.
Reaktionen von Alkanen
Alkane lassen sich zwar mit Luftsauerstoff unter hoher Energiefreisetzung zu Kohlendioxid und Wasser verbrennen, unter milden Bedingungen sind sie allerdings gegenüber Sauerstoff und anderen Reagenzien innert. Daher rührt die frühere Bezeichnung „Paraffine“ (parum affinis = wenig reaktionsfähig).
Alkane reagieren mit Chlor oder Brom bei erhöhter Temperatur oder unter Einfluss von Licht zu den entsprechenden Halogenalkanen. Im Falle des Methans entstehen mit Chlor nacheinander Chlormethan (CH3Cl), Dichlormethan (CH2Cl2), Trichlormethan (= Chloroform, CHCl3) und Tetrachlormethan (CCl4). Es werden also die Wasserstoffatome nach und nach gegen Chloratome ausgetauscht. Diese Reaktion verläuft bei 20°C im Dunkeln nicht ab, dagegen bei Belichtung explosionsartig. Durch die Lichtenergie wird die Cl-Cl-Bindung homolytisch gespalten, so dass in der Startreaktion zwei Chloratome entstehen. Anschließend folgt ein Reaktionszyklus, der vielfach durchlaufen wird, die so genannte Kettenreaktion. Hierbei entreißt das Chloratom einem Methanmolekül ein Wasserstoffatom unter Bildung eines Kohlenstoffradikals. Dieses wiederum spaltet ein neues Chlormolekül und bildet dadurch erneut ein Chloratom. Diese Kettenreaktion wird solange durchlaufen bis zwei Radikale zusammenstoßen. Da die Konzentration der Radikale aber sehr gering ist, passiert dies nur selten. Dieser letzte Schritt wird als Kettenabbruch bezeichnet.
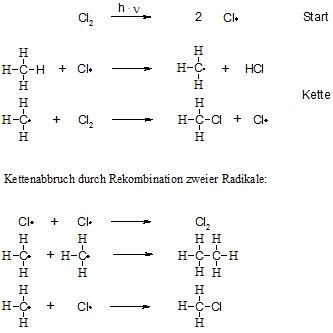
Die drei verbliebenen Wasserstoffe im Chlormethan (CH3Cl) können auf gleiche Weise nun durch Chloratome angegriffen werden.
Die analoge Reaktion mit Brom läuft ebenfalls ab, jedoch nur langsam und nicht explosionsartig wie beim Chlor. Demgegenüber reagiert Iod nicht mit Alkanen. Dieses Ergebnis wollen wir energetisch betrachten und erklären. Kettenstart und –abbruch können wir dabei vernachlässigen denn sie laufen für einen vielfachen Kettenzyklus nur einmal ab.
Die Bindungsenergien bei 25°C für folgende Bindungen betragen:
| F-F | : 158 kJ/mol | H-F | : 561 kJ/mol | C-F | : 448 kJ/mol |
| Cl-Cl | : 243 kJ/mol | H-Cl | : 432 kJ/mol | C-Cl | : 339 kJ/mol |
| Br-Br | : 193 kJ/mol | H-Br | : 366 kJ/mol | C-Br | : 285 kJ/mol |
| I-I | : 151 kJ/mol | H-I | : 299 kJ/mol | C-I | : 213 kJ/mol |
| C-H | : 413 kJ/mol |
Danach ergeben sich folgende Rechnungen, wobei die vom System zur Spaltung einer Bindung benötigte Energie negativ und die vom System durch Bildung einer Bindung abgegebene Energie positiv gewertet ist.
Fluorierung:
| 1. | – 413 kJ/mol | + 561 kJ/mol | |||
| 2. | – 158 kJ/mol | + 448 kJ/mol | Summe: | + 438 kJ/mol |
Chlorierung:
| 1. | – 413 kJ/mol | + 432 kJ/mol | |||
| 2. | – 243 kJ/mol | + 339 kJ/mol | Summe: | + 115 kJ/mol |
Bromierung:
| 1. | – 413 kJ/mol | + 366 kJ/mol | |||
| 2. | – 193 kJ/mol | + 285 kJ/mol | Summe: | + 45 kJ/mol |
Iodierung:
| 1. | – 413 kJ/mol | + 299 kJ/mol | |||
| 2. | – 151 kJ/mol | + 213 kJ/mol | Summe: | – 52 kJ/mol |
Das Ergebnis zeigt, dass die Fluorierung, Chlorierung und Bromierung exotherm sind während für die Iodierung Energie benötigt wird. Bei den Reaktionen mit Fluor und Chlor wird dabei so viel Energie frei, dass die Reaktionen explosionsartig verlaufen.
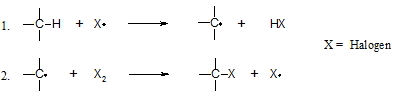
Nun soll noch untersucht werden, ob Wasserstoffe von Alkanen, die an primären, sekundären oder tertiären Kohlenstoffatomen gebunden sind gleich oder unterschiedlich schnell mit einem Halogen, z.B. Chlor, reagieren. Hierfür nehmen wir an, dass nur ein Wasserstoffatom von 2-Methyl-butan durch Chlor substituiert wird. Es sind dann vier isomere Produkte möglich, nämlich 1-Chlor-2-methyl-butan (1), 1-Chlor-3-methyl-butan (2), 2-Chlor-3-methyl-butan (3) und 2-Chlor-2-methyl-butan (4). Zur Bildung von 1 stehen sechs Wasserstoffatome von zwei chemisch gleichwertigen Methylgruppen zur Verfügung. Zur Bildung von 2 sind es drei Wasserstoffatome (eine Methylgruppe), von 3 sind es zwei (eine Methylengruppe) und von 4 nur ein Wasserstoffatom (eine Methingruppe). Somit sollte man ein statistisches Produktverhältnis von sechs Teilen 1, drei Teilen 2, zwei Teilen 3 und einem Teil 4 erwarten. Gefunden werden aber sechs Teile 1, drei Teile 2, 6,6 Teile 3 und 4,4 Teile 4. Das bedeutet, dass die Methingruppe am leichtesten reagiert (Faktor 4,4), gefolgt von der Methylengruppe (Faktor 3,3). Die Methylgruppen werden am schlechtesten angegriffen (Faktor 1). Begründen lässt sich dies damit, dass das Kohlenstoffradikal, das als energiereiche Zwischenstufe kurzfristig gebildet wird, umso stabiler ist, je höher es substituiert ist bzw. je weniger Protonen es trägt.
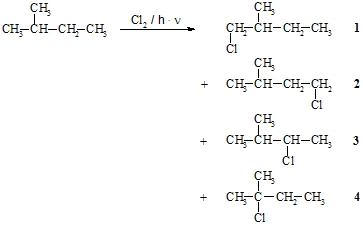
Cycloalkane
Gesättigte ringförmige Kohlenwasserstoffe werden auf Grund ihrer Konstitution als Cycloalkane bezeichnet. Auch wenn die Fünf- und Sechsringe wegen ihrer optimalen Bindungswinkel im Ring am günstigsten sind, kommen auch größere und kleinere Ringe (auch in Naturstoffen) vor.
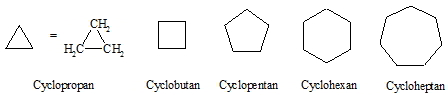
Aus Gründen der Vereinfachung werden bei cyclischen Verbindungen keine „C“ und „H“ geschrieben. Vereinbarungsgemäß befindet sich an jeder Ecke ein Kohlenstoffatom, das mit Wasserstoffen abgesättigt ist. Befinden sich dort andere Atome oder Reste, so müssen diese geschrieben werden. Außer dem Cyclopropan sind alle Cycloalkane nicht planar. Die Ausbildung einer räumlichen Struktur führt zu einem günstigeren Bindungswinkel im Ring. Dies soll am Beispiel des Cyclohexans gezeigt werden. Im planaren Sechsring wäre der Winkel mit 120° etwa 11° größer als der Tetraederwinkel. In der so genannten Sessel- und Wannenform bleibt die tetraedrische Konfiguration erhalten.
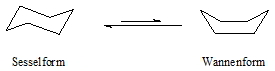
Sessel- und Wannenform sind die beiden bevorzugten Konformationen des Cyclohexans. Die Konformeren sind nicht isolierbar, da sich beide rasch ineinander umwandeln. Die Sesselform ist gegenüber der Wannenform um etwa 30 kJ/mol günstiger so dass diese bei 20°C zu 99% im Gleichgewicht vorliegt. Dies liegt daran, dass in der Sesselform alle Wasserstoffatome in der günstigen staggered Konformation angeordnet sind, während in der Wannenform die Wasserstoffatome in 2.3- und 5.6-Stellung in der energetisch ungünstigen eclipsed Konformation stehen, bei einer gleichzeitigen sterischen Hinderung je eines Wasserstoffs in den Positionen 1 und 4. Dies ist am besten in einem Molekülmodell zu erkennen. Bei der Sesselform unterscheidet man zwischen äquatorial (e) und axial (a) angeordneten Wasserstoffatomen (oder allgemein Substituenten). Während die äquatorialen Substituenten etwa in der Ebene des Ringes liegen, befinden sich die axialen jeweils oberhalb oder unterhalb dieser Ebene.
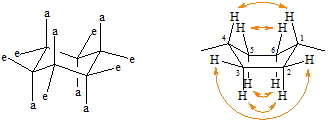
Die Unterscheidung zwischen e- und a-Stellung ist vor allem bei substituierten Cyclohexanen wichtig. Von den danach möglichen zwei Methylcyclohexananen ist infolge der raschen Umwandlung einer Sesselform in die andere nur eines bekannt. Diese rasche Umwandlung beider Konformationen ineinander bezeichnet man als Ringinversion. Die Inversionsfrequenz beträgt bei Cyclohexan 106/sek.
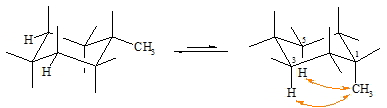
Bei allen monosubstituierten Cyclohexanderivaten ist die äquatoriale Stellung des Substituenten (hier CH3) bevorzugt, da dabei die geringere sterische Behinderung vorliegt. Ist die Methylgruppe in axialer Stellung so kommt es zu sterischen Wechselwirkungen mit den oben eingezeichneten Wasserstoffatomen an C-3 und C-5.
Bei di- oder mehrfach substituierten Cyclohexanderivaten kommen neben strukturisomeren Verbindungen auch so genannte geometrische Isomere (cis–trans-Isomere) vor, das heißt, die Substituenten sind in beiden Verbindungen an den gleichen Kohlenstoffatomen gebunden, stehen aber räumlich unterschiedlich zueinander. Dies soll an 1,2-Dimethylcyclohexan gezeigt werden. Befinden sich beide Substituenten auf der gleichen Seite der Ringebene, so sagt man, sie stehen cis zueinander, sind sie aber auf gegenüberliegenden Seiten, so sind sie trans-ständig. Im folgenden Beispiel befinden sich die beiden Methylgruppen an benachbarten Kohlenstoffatomen, sie sind also 1,2-ständig. Stehen beide Methylgruppen in axialer Position, so sind sie trans-ständig. Durch Umwandlung von der einen in die andere Sesselkonformation kommen diese Substituenten automatisch beide in equatoriale Stellungen. Auch hier stehen sie trans zueinander. Ist eine Methylgruppe in axialer Position und die andere in equatorialer, so stehen beide cis zueinander.
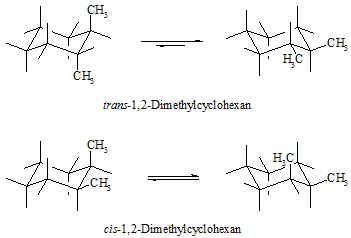
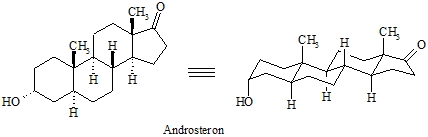
Die räumliche Struktur eines Moleküls ist sehr wichtig für seine biologische Aktivität. Als Beispiele für solche Verbindungen mit einem oder mehreren Cyclohexangerüsten seien das Insektizid Lindan, der Wachstumsfaktor myo-Inosit und die Klasse der Steroide wie z.B. die Steroidhormone (Androgene, Östrogene, Gestagene, Corticosteroide usw.) genannt.
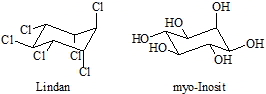
Lindan ist eines von acht Stereoisomeren des 1,2,3,4,5,6-Hexachlorcyclohexans. Die Chloratome sind hier aaaeee angeordnet. Bezüglich der Toxizität bestehen zwischen den einzelnen Isomeren deutliche Unterschiede.
Im Decalin können die beiden 6-Ringe trans oder cis verknüpft sein. Entsprechend unterschiedlich ist die räumliche Struktur, wie unter gezeigt.
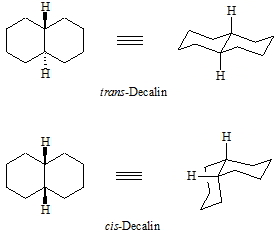
Das Grundgerüst des Decalins ist in den Steroiden enthalten. Dies soll an Beispiel des Androsterons gezeigt werden. Hier sind alle drei 6-Ringe trans verknüpft, was für die räumliche Struktur des Moleküls und für dessen biologische Wirkung sehr wichtig ist. Auch die Verknüpfung zwischen dem 5- und 6-Ring ist trans.