Nomenklatur der Carbonsäuren
Alle Carbonsäuren enthalten eine oder mehrere Carboxylgruppen, -COOH, eine Kombination aus einer Carbonyl- (C=O) und einer Hydroxylgruppe (O-H). Beide Gruppierungen üben einen starken Einfluß aufeinander aus. Die Carboxylgruppe zeigt nicht nur ein ähnliches Verhalten wie Alkohole bzw. Aldehyde und Ketone, sondern besitzen auch neue Eigenschaften.
| H-COOH | Ameisensäure |
| CH3-COOH | Essigsäure |
| CH3-CH2-COOH | Propionsäure |
| CH3-(CH2)2-COOH | Buttersäure |
| CH3-(CH2)3-COOH | Valeriansäure |
| CH3-(CH2)8-COOH | Caprinsäure |
| CH3-(CH2)10-COOH | Laurinsäure |
| CH3-(CH2)12-COOH | Myristinsäure |
| CH3-(CH2)14-COOH | Palmitinsäure |
| CH3-(CH2)16-COOH | Stearinsäure |
| CH3-(CH2)18-COOH | Arachinsäure |
| CH3-(CH2)5-CH=CH-(CH2)7-COOH | Palmitoleinsäure |
| CH3-(CH2)7-CH=CH-(CH2)7-COOH | Ölsäure |
| HOOC-COOH | Oxalsäure |
| HOOC-CH2-COOH | Malonsäure |
| HOOC-(CH2)2-COOH | Bernsteinsäure |
| HOOC-(CH2)3-COOH | Glutarsäure |
| HOOC-(CH2)4-COOH | Adipinsäure |
| HOOC-CH=CH-COOH (cis) | Maleinsäure |
| HOOC-CH=CH-COOH (trans) | Fumarsäure |
Ameisensäure findet sich in freier Form in Ameisen und Brennesseln. Bei den Ameisen ist sie sowohl Wehrstoff als auch Pheromon. Konzentrierte Essigsäure wird auch als Eisessig bezeichnet, da sie bei 15°C eisartig erstarrt. Buttersäure liegt in der Butter verestert vor. Durch mikrobiellen Abbau wird die stinkende Buttersäure freigesetzt; die Butter wird ranzig.
Da einzelne dieser Säuren mit Glycerin verestert auch in den Fetten vorkommen (s. Kapitel XX), bezeichnet man vor allem die höhermolekularen Carbonsäuren auch als Fettsäuren.
Für die Numerierung der Kohlenstoffkette gibt es zwei verschiedene Möglichkeiten. Entweder man beginnt bei dem Carboxylkohlenstoff mit „1“ oder beim nächsten Kohlenstoffatom mit „“.
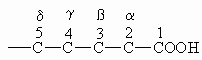
Eigenschaften von Carbonsäuren
Die Carbonylgruppe ist polar. Die Siedepunkte der Carbonsäuren liegen höher als die der entsprechenden Aldehyde. Dies beruht auf der Fähigkeit der Carboxylgruppe, Wasserstoffbrückenbindungen zu bilden. In Lösung liegen die Carbonsäuren in dimerer Form vor. Die Wasserstoffbrückenbindungen sind auch verantwortlich für die Wasserlöslichkeit der niederen Glieder der Carbonsäuren (bis zur Buttersäure).
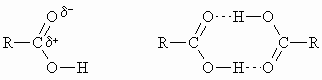
Die Acidität der Carbonsäuren übertrifft die der Alkohole, d.h. die Neigung der Hydroxylgruppe zur Abgabe eines Protons nimmt in der Reihenfolge zu:
R-O-H < H-O-H < R-CO-O-H
Im Vergleich zu den Mineralsäuren sind die Carbonsäuren aber schwache Säuren, deren Salze in Wasser teilweise hydrolysieren. Die Carbonsäuren sind jedoch acider als die Kohlensäure.
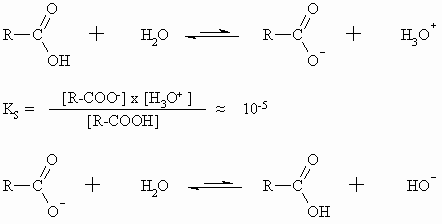
Die Ursache für die Acidität der Carboxylgruppe ist der mit dem Übergang in die dissoziierte Form verbundene Gewinn an Mesomerieenergie.
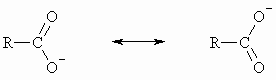
Die beiden mesomeren Grenzstrukturen des Carboxylatanions sind energetisch äquivalent. Die negative Ladung ist auf beide Sauerstoffe gleich verteilt. Der Abstand beider CO-Bindungen ist gleich.
Die Acidität der Carbonsäuren wird durch Substituenten im Alkylrest beeinflußt. Z.B. erhöhen Elektronen ziehende Reste wie Halogene, vor allem am -Kohlenstoffatom, durch ihren induktiven Effekt die Acidität.
| Essigsäure, CH3-COOH | KS = 1,75 x 10-5 |
| Chloressigsäure, ClCH2-COOH | KS = 1,4 x 10-3 |
| Dichloressigsäure, Cl2CH-COOH | KS = 1,14 x 10-2 |
| Trichloressigsäure, Cl3C-COOH | KS = 1,21 x 10-1 |
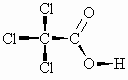
Der induktive Effekt nimmt als elektrostatisches Phänomen mit dem Quadrat der Entfernung ab. Deshalb haben Substituenten am ß- oder gar weiter entfernten Kohlenstoffatom weniger Einfluß auf die Acidität der Carbonsäure.
Die Salze mancher Carbonsäure haben von diesen abweichende Name, z.B.:
Ameisensäure: Formiate
Essigsäure: Acetate
Palmitinsäure: Palmitate
Stearinsäure: Stearate
Oxalsäure: Oxalate
Die Salze der höheren Carbonsäuren (= Fettsäuren) werden wegen ihrer entsprechenden Wirkung als Seifen bezeichnet wobei die Natriumsalze Kernseifen und die Kaliumsalze Schmierseifen genannt werden. Die Waschwirkung der Seifen beruht auf der Herabsetzung der Oberflächenspannung und auf einer Emulgatorwirkung. Die Oberflächenspannung wird durch solche Stoffe herabgesetzt, die sowohl hydrophile (hier: COO–) als auch hydrophobe Gruppen (hier: langer Kohlenwasserstoffrest) im gleichen Molekül enthalten. Diese Stoffe heben die Ursache für die Oberflächenspannung auf. Während sich nämlich die Molekularen Attraktionskräfte im Inneren einer Flüssigkeit gegenseitig aufheben, sind die Oberflächenmoleküle nicht mehr kräftefrei; es resultiert ein Zug nach innen. Daraus ergibt sich die Tendenz, die Oberfläche zu verkleinern.
Die Seifenmoleküle ordnen sich an der Wasseroberfläche so an, dass die hydrophile Seite dem Wasser stets zugekehrt ist und die hydrophoben Alkylreste aus der Oberfläche heraus ragen. Die so angeordneten Seifenmoleküle (Anionen) setzen dem Zug in das Innere der Lösung einen Widerstand entgegen, da sonst die hydrophoben Teile auch vom Wasser aufgenommen werden müssten. Dies bedingt eine Verminderung der Oberflächenspannung.
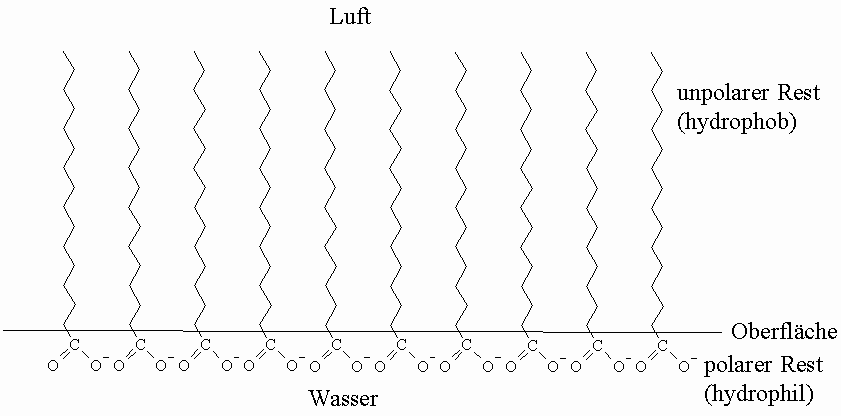
Die Waschwirkung der Seifen beruht darauf, daß die hydrophoben Alkylreste gleichzeitig lipophil sind. Während Fette allein von Wasser nicht benetzt werden, übt die Seife auf die Trennfläche Wasser zu Fett eine vermittelnde Wirkung aus und ermöglicht die Benetzung. Dabei ragen die Alkylreste in das Fett und die Carboxylatgruppen in die wäßrige Phase. Durch die Emulgation wird schließlich die Ablösung der Fettschicht und ihre feine Verteilung in der Waschflüssigkeit bewirkt.
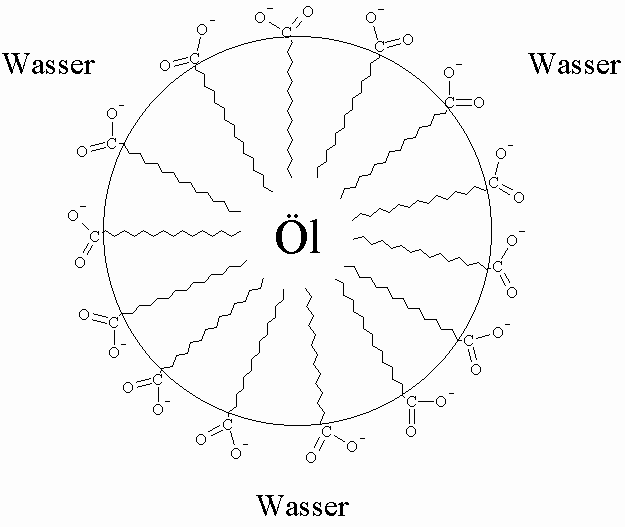
Ein Nachteil dieser Seifen ist die schlechte Löslichkeit ihrer Calciumsalze in Wasser. Je nach Wasserhärte geht ein Teil der Seifenwirkung verloren da die Calciumsalze der Fettsäuren keine Waschwirkung besitzen.
[CH3-(CH2)16-COO]2Ca
Darstellung von Carbonsäuren
Carbonsäuren lassen sich durch Oxidation von primären Alkoholen (s. Kapitel „Alkohole“) und Aldehyden (s. Kapitel „Carbonyle“) darstellen. Auch bei der oxidativen Spaltung von Alkenen mit Ozon, Kaliumdichromat oder Kaliumpermanganat im sauren Medium entstehen Carbonsäuren (s. Kapitel „Alkene“). Weiterhin werden Nitrile sauer oder basisch zu Carbonsäuren hydrolysiert (s. Kapitel „Carbonsäurederivate“).
Reaktionen von Carbonsäuren
Normalerweise werden die Carbonsäuren oxidativ nicht angegriffen. Eine Sonderstellung nimmt allerdings die Ameisensäure ein. Da sie, wie auch die Aldehyde, eine –CHO-Gruppe besitzt, ist sie gegen Oxidationsmittel genauso empfindlich wie diese. Dabei entsteht Kohlensäure bzw. Kohlendioxid.
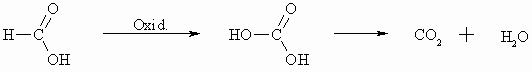
Als Oxidationsmittel können z.B. Kaliumpermanganat, Kaliumdichromat oder ammoniakalische Silbernitratlösung eingesetzt werden.
Mit Lithium-aluminium-hydrid werden Carbonsäuren zu den entsprechenden Alkoholen reduziert.
![]()
An der C=O-Doppelbindung der Carboxylgruppe können Additionsreaktionen durchgeführt werden, wobei, wie bei den Aldehyden und Ketonen, der Carboxylkohlenstoff nucleophil bzw. der Sauerstoff elektrophil angegriffen wird. Diese Reaktionen werden im Kapitel „Carbonsäurederivate“ behandelt.