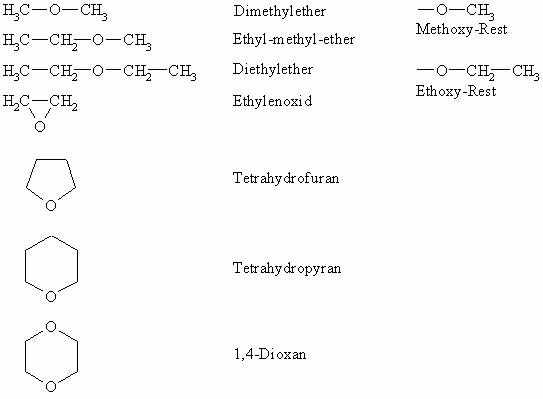
Nomenklatur der Ether
Während der Ersatz eines Wasserstoffatoms im Wasser durch einen Alkylrest zu den Alkoholen führt, sind in den Ethern beide Wasserstoffatome durch Alkylreste ausgetauscht. Je nach ihrem Aufbau werden einfache (zwei gleiche Alkylreste) und gemischte Ether (unterschiedliche Alkylreste) unterschieden. Ihre Benennung erfolgt durch Voranstellen der Namen der Alkylreste in alphabetischer Reihenfolge vor –ether.
Eigenschaften von Ethern
Im Gegensatz zu Wasser und Alkoholen haben die Ether niedrige Siedepunkte, da die Bildung von Wasserstoffbrücken zwischen den Ether-Molekülen nicht mehr möglich ist; sie haben kein zur Brückenbindung befähigtes Wasserstoffatom. Diethylether ist in Wasser nur sehr wenig, in Alkoholen gut löslich. Ether sind polare aprotische Lösungsmittel.
Ether sind äußerst leicht entflammbar und Ether/Luft-Gemische sind explosiv. Gegenüber vielen Reagenzien sind Ether relativ stabil, sodass sie als Lösungsmittel eingesetzt werden können. Diethylether hat einen angenehm süßlichen Geruch und ruft bei längerem Einatmen Bewusstlosigkeit hervor. Er wird als Narkosemittel eingesetzt, ist aber weitgehendst durch andere Mittel ersetzt worden. Der Mechanismus als Anästhetikum ist unbekannt.
Darstellung von Ethern
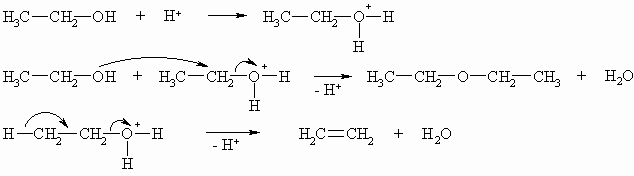
Ether lassen sich durch Abspaltung von Wasser (Substitutionsreaktion) aus zwei Molekülen Alkohole darstellen. Diese Reaktion wird mit Schwefelsäure katalysiert. Als Nebenprodukte sind immer Alkene (Eliminierungsreaktion) zu erwarten. Auf diese Weise lassen sich aber sinnvoll nur symmetrische Ether darstellen.
Für die Darstellung von unsymmetrischen Ethern wählt man die Synthese nach Williamson ausgehend von Alkoholat und Alkylhalogenid. Das Alkoholat wird aus dem entsprechenden Alkohol und metallischen Natrium hergestellt (siehe Kapitel „Alkohole“).
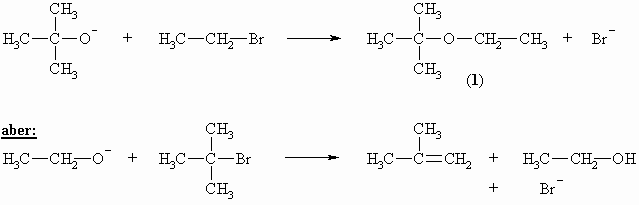
Bei richtiger Auswahl der Reagenzien, tert.-Butanolat und Ethylbromid, entsteht im obigen Beispiel das Substitutionsprodukt, Ethyl-tert.-butyl-ether (1). Wird umgekehrt Ethanolat als Base und tert.-Butylbromid eingesetzt, so greift die Base ein Proton an der Peripherie des Halogenids an und es kommt zu einer Eliminierungsreaktion.
Reaktionen von Ethern
Auch wenn die Ether, wie schon bei seinen Eigenschaften erwähnt, gegenüber vielen Reagenzien nur eine geringe Reaktivität zeigen, so sind sie doch mit äußerster Vorsicht zu handhaben. Erwähnt wurde seine Brennbarkeit und die Explosionsfähigkeit. Weiterhin bilden Ether mit Luftsauerstoff unter Einfluss von Lichtenergie in einer radikalischen Reaktion sehr gefährliche, hoch explosive Hydroperoxide. Dabei greift der Luftsauerstoff als Biradikal immer ein Wasserstoffatom am Kohlenstoffatom neben dem Ethersauerstoff an.
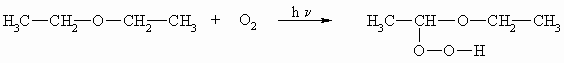
Die Hydroperoxide sind wesentlich höher siedend als die zugrunde liegenden Ether. Bei einer Destillation reichern sich somit die Peroxide im Rückstand an; ab einer kritischen Konzentration kommt es dann zur Explosion. Man lagert Ether in braunen Flaschen, um durch Lichtausschluss die Peroxidbildung zu vermeiden. Ob ein Ether Peroxid enthält lässt sich mit Kaliumiodid testen. Dieses wird durch das Peroxid zu Iod oxidiert, das mit Stärke einen blauen Komplex bildet. Mit Eisen(II)-Salzen oder mit Al2O3 können die Hydroperoxide entfernt werden.
Da Ether am Sauerstoff kein Wasserstoffatom mehr tragen, sind sie auch nicht acide. Sie können aber wie Alkohole Protonen aufnehmen und haben somit schwach basische Eigenschaften.
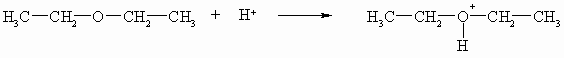
Diese Eigenschaft nutzt man, um Ether mithilfe von Iodwasserstoffsäure zu spalten.
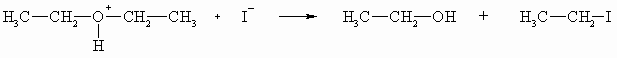
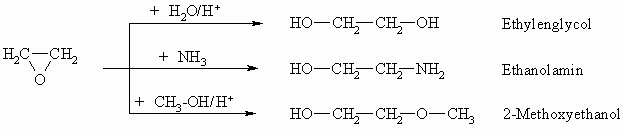
Ausgehend von Ethylenoxid lässt sich eine Reihe wichtiger Substanzen herstellen: