Die Studien der optischen Aktivität begannen schon im 18. Jahrhundert mit der Beobachtung, dass viele Naturstoffe die Ebene des linear polarisierten Lichtes drehen. Z.B. fand Pasteur zwei Kristallformen eines Salzes der Traubensäure, die sich wie Bild- und Spiegelbild verhielten. Er stellte fest, dass die beiden Verbindungen in Lösungen von gleicher Konzentration die Schwingungsebene des Lichtes um den gleichen Betrag, jedoch im entgegengesetzten Sinne drehen.
Das Polarimeter
Beim Durchgang linear polarisierten Lichts durch eine optisch aktive Substanz wird seine Schwingungsebene gedreht. Der Betrag dieser Drehung wird in Graden in einem Polarimeter gemessen.
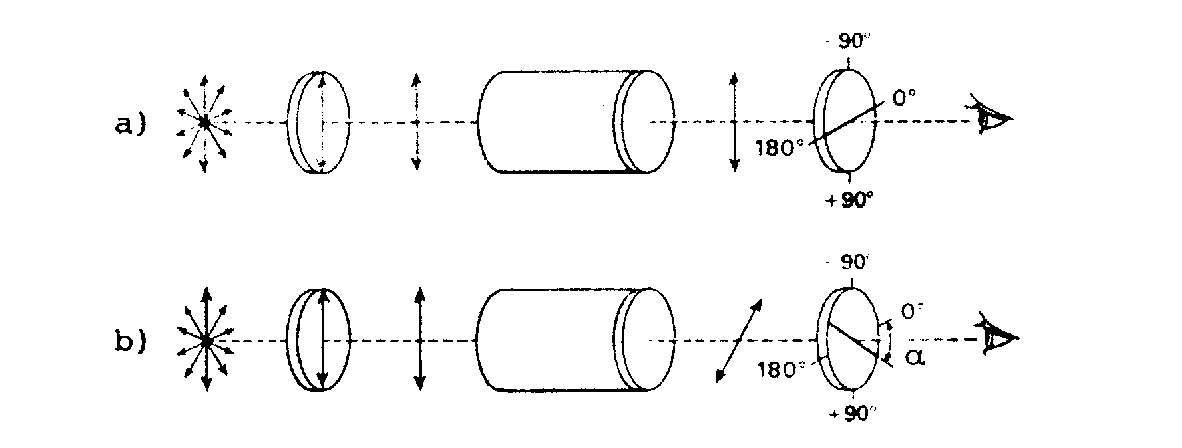
L = Lichtquelle
P = Polarisierungsgitter
S1 = Schwingungsebene des Lichtes vor der Küvette
K = Küvette
S2 = Schwingungsebene des Lichtes nach der Küvette
A = Analysatorgitter
B = Beobachter oder Detektor
a) Küvette ohne Probe
b) Küvette mit optisch aktiver Probe
Der Drehwinkel ist von mehreren Faktoren abhängig: von der Konzentration der Probe, der Länge der Küvette, der Temperatur, der Wellenlänge des Lichtes, dem Lösungsmittel und natürlich von der Struktur der Substanz. Man hat deshalb die spezifische Rotation [] definiert bei der die Konzentration mit 1 g/ml und die Länge der Küvette mit 10 cm festgelegt wurden. Temperatur (T), Wellenlänge () der benutzten monochromatischen Strahlung und Lösungsmittel müssen dann noch wie folgt angegeben werden: []T = x° (in „Lösungsmittel“). Befindet sich eine optisch aktive Substanz in der Küvette, so muss das Analysatorgitter gedreht werden bis der ohne Probe vorhandene Helligkeitszustand wieder erreicht ist. Eine Drehung im Uhrzeigersinn wird als Rechtsdrehung (+), die entgegengesetzte als Linksdrehung (–) bezeichnet.
Struktur und optische Aktivität
Die optische Aktivität tritt dann auf, wenn ein Kohlenstoffatom von vier verschiedenen Resten oder Atomen tetraedrisch umgeben ist. Dann gibt es, je nach räumlicher Ausrichtung der Reste, zwei isomere Verbindungen. Als Beispiel dient uns die Milchsäure.
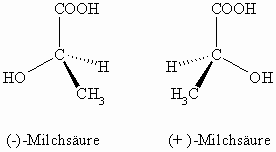
Die zwei Milchsäuremoleküle verhalten sich wie Bild- zu Spiegelbild. Sie sind chiral und man nennt solche Paare auch Enantiomere. Enantiomere haben gleiche physikalische Eigenschaften (Schmelzpunkt, Siedepunkt, Dichte, Löslichkeit), nur der Drehwert, der vom absoluten Betrag her gleich ist, unterscheidet sich im Vorzeichen. Häufig gibt es aber bei der physiologischen Aktivität Unterschiede; so kann ein Isomeres lebensnotwendig sein, das andere jedoch ist giftig. Man kann nun, wie oben, die beiden Isomeren durch voranstellen der gemessenen Drehrichtung als (-)- und (+)-Milchsäure namentlich unterscheiden. Dies hat aber den Nachteil, dass man immer erst das physikalische Experiment mit dem Polarimeter durchführen muss, bevor man die Substanz benennen kann. Es gibt keine Gesetzmäßigkeit zwischen der absoluten, räumlichen Struktur eines Moleküls und der Drehrichtung. Nehmen wir statt der Milchsäure seinen Methylester so sehen wir, dass sich die Drehrichtung (und natürlich auch der absolute Betrag) geändert hat.
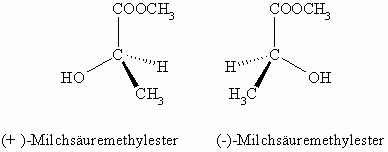
Man hat deshalb nach einer Möglichkeit gesucht, die beiden Isomeren nach ihrer räumlichen Struktur zu benennen.
Fischer-Projektion
Lange Zeit konnte man die Enantiomeren nur nach der Drehrichtung des linear polarisierten Lichts mit (+) oder (-) benennen. Auf der anderen Seite konnte man absolute Konfigurationen zeichnen. Man konnte aber nicht zuordnen, welches Enantiomere welche absolute Konfiguration besitzt. Für die Schreibweise optisch aktiver Moleküle benutzt man meist die von Emil Fischer eingeführte Projektionsformel; die räumliche Struktur wird in die Zeichenebene projiziert. Dabei wird die Kohlenstoffkette vertikal so angeordnet, dass das am höchsten oxidierte Kohlenstoffatom oben steht. Weiterhin befindet sich das chirale Kohlenstoffatom (= Chiralitätszentrum = C-Atom mit vier verschiedenen Resten) in der Zeichenebene und die nächsten Kohlenstoff-Nachbarn nach oben und unten stehen unterhalb der Papierebene. Damit stehen die beiden anderen Substituenten, meist Wasserstoff und eine funktionelle Gruppe (hier: OH), rechts und links oberhalb der Zeichenebene also zum Betrachter hin. Befindet sich die funktionelle Gruppe dann auf der rechten Seite, so benennt man diese Verbindung durch ein voran gestelltes D- (von dexter), steht sie links, spricht man von L- (von laevus).
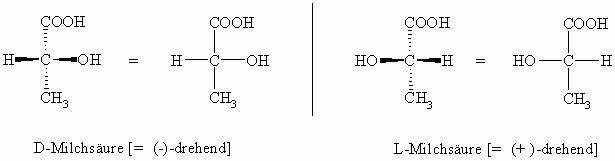
Cahn-Ingold-Prelog-Nomenklatur
Die oben angegebene Benennung von Enantiomeren nach Fischer ist für viele Naturstoff-Klassen wie z.B. Aminosäuren und Zucker gut geeignet und wird hier auch überwiegend benutzt. Bei manch anderer optisch aktiven Verbindung wie z.B. 3-Methyl-hexan. versagt sie, da hier keine Kohlenstoffkette sondern eine Verzweigung vorliegt und auch kein höchst oxidiertes Kohlenstoffatom existiert, das nach oben gezeichnet werden kann. Deshalb entwickelten R.S. Cahn, C.K. Ingold und V. Prelog ein weiteres Nomenklatur-System. Danach werden die vier Reste am Chiralitätszentrum nach ihrer Priorität, d.h. nach fallender Ordnungszahl der am chiralen Kohlenstoffatom direkt gebundenen Atome geordnet. Sind zwei oder gar mehrere dieser Atome gleich, so wird die Summe der Ordnungszahlen der daran gebundenen Atome der sogenannten zweiten Sphäre für die Zuordnung herangezogen. Notfalls muss man noch die Atome der dritten oder gar vierten Sphäre in Betracht ziehen. Dabei zählen Atome, die durch eine Doppelbindung gebunden sind, auch doppelt. Das Tetraedermodell wird nun so angeordnet, dass das Atom mit der niedrigsten Priorität nach hinten zeigt, das Chiralitätszentrum in der Zeichenebene ist und damit die drei verbleibende Atome oder Reste nach vorne zeigen. Diese sind jetzt nach fallender Priorität im (R- von rectus) oder gegen den Uhrzeigersinn (S- von sinister) angeordnet. Betrachten wir nun das schon oben erwähnte 3-Methyl-hexan:
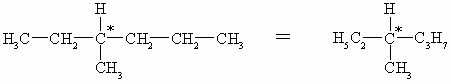
Am Chiralitätszentrum (C*) befinden sich folgende vier Atome: einmal H (Ordnungszahl 1) und dreimal C (Ordnungszahl jeweils 6). Diese drei Kohlenstoffatome der zweiten Sphäre müssen nun nach ihrer Priorität unterschieden werden. Ein Kohlenstoffatom (Methylgruppe) trägt nur dreimal H (3 x 1 = 3) und die anderen beiden binden ein weiteres Kohlenstoffatom und zwei Wasserstoffe (1 x 6 + 2 x 1 = 8). Jetzt müssen noch der Ethyl- und der Propylrest nach ihrer Priorität unterschieden werden. Wir gehen deshalb ein Atom weiter, also in die dritte Sphäre. Hier ist in der Ethylgruppe CH3 und und in der Propylgruppe CH2-C. Folglich sind die Reste am Chiralitätszentrum wie folgt nach abnehmender Priorität zu ordnen: Propylrest (C3H7), Ethylrest (C2H5), Methylrest (CH3), Wasserstoffatom. Letzteres muß, wie oben schon erwähnt, nach hinten stehen:
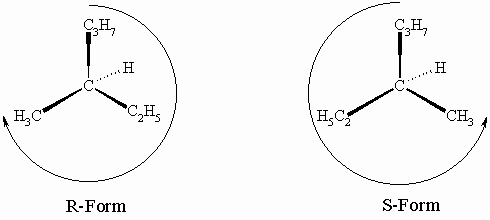
Nach fallender Priorität kommt man im linken Molekül im Uhrzeigersinn von C3H7 über C2H5 nach CH3 (es ist also R-3-Methyl-hexan) und im rechten gegen den Uhrzeigersinn von C3H7 über C2H5 nach CH3 (S-3-Methyl-hexan). Damit ist es gelungen, beiden Isomeren unterschiedliche Namen zuzuordnen.
Wir haben nun drei Systeme kennengelernt, nach denen man optisch aktive Verbindungen benennen kann. Welches System man anwendet ist grundsätzlich jedem selbst überlassen; man sollte sich aber möglichst daran halten, was allgemein üblich ist. Die Unterscheidung von Enantiomeren nach (+) und (–) setzt ein physikalisches Experiment voraus und ist deshalb umständlich und sie hat keine Korrelation zur absoluten Struktur. Bei den biologisch wichtigen Verbindungen wie z.B. Aminosäuren, Hydroxycarbonsäuren und Zuckern wird üblicher Weise die Nomenklatur von Fischer angewendet aber es ist natürlich nicht verboten, diejenige nach Cahn, Ingold und Prelog zu benutzen. Wir wollen dies am Beispiel der schon oben erwähnten Milchsäure zeigen. Das Chiralitätszentrum bindet folgende Atome oder Gruppen: H (OZ 1), zweimal C (CH3 und COOH, OZ der ersten Sphäre jeweils 6) und O (von OH, OZ 8). Die Reihenfolge der Priorität von CH3 und COOH muss nun noch festgelegt werden. Das Kohlenstoffatom der Methylgruppe trägt drei H (OZ 3 x 1 = 3) und das der COOH-Gruppe ein doppelt gebundenes O und ein einfach gebundenes O (OZ 2 x 8 + 1 x 8 = 24). Danach sind die Substituenten am Chiralitätszentrum wie folgt nach abnehmender Priorität zu ordnen: OH, COOH, CH3, H.
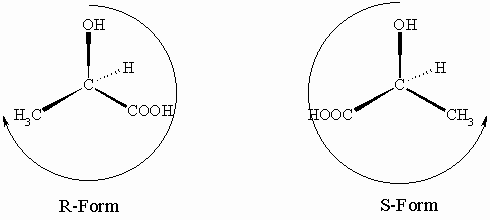
Die (–)-Milchsäure ist je nach verwendeter Nomenklatur gleich der D- bzw. der R-Milchsäure und die (+)-Milchsäure ist gleich der L- bzw. der S-Milchsäure.
Das Gemisch von gleichen Mengen zweier enantiomerer Verbindungen wird als Racemat bezeichnet. Hierin heben sich die Wirkungen auf das linear polarisierte Licht gegeneinander auf; damit wird das Licht nicht aus seiner Schwingungsebene gedreht.